

Sponsored Link
反応速度、概論
化学反応において、反応速度はとても重要な概念です。例えば、薬を溶かして溶液にしたとします。溶液は時間が経過することで薬の成分が分解されていき薬効が消失していきます。今回は反応速度について見ていきたいと思います。
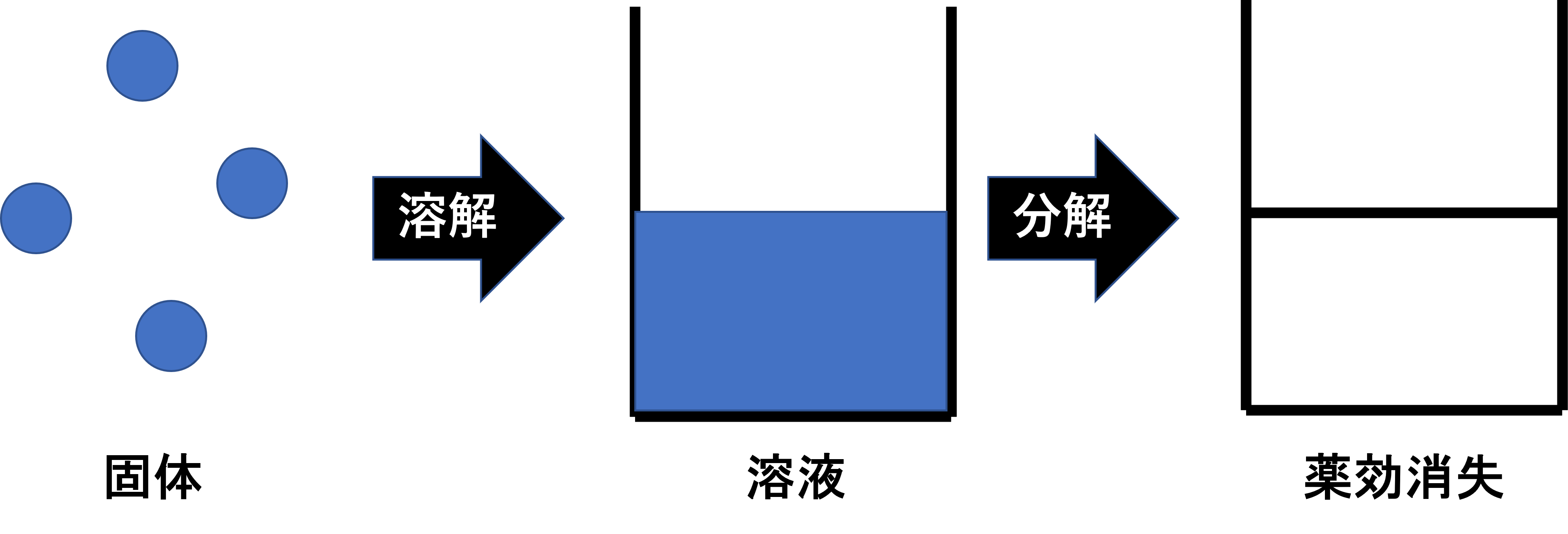
反応速度
反応速度は単位時間当たりの反応物の減少量や生成物の増加量で表されます。例えば、薬が分解するような反応では反応速度(−dC/dt)は以下の式で表されます。
- (−dC/dt)=kC^n
- k;反応速度定数
- C;反応物濃度
- t;経過時間
- n;反応次数
この反応次数に応じて以下のようにわけられます。
- 0次反応
- 1次反応
- 2次反応
Sponsored Link
Sponsored Link
0次反応
0次反応では、一定速度で分解します。例えば、薬が全部で12個あったとしましょう。そして、1時間たつごとに3個ずつ分解されていくとします。
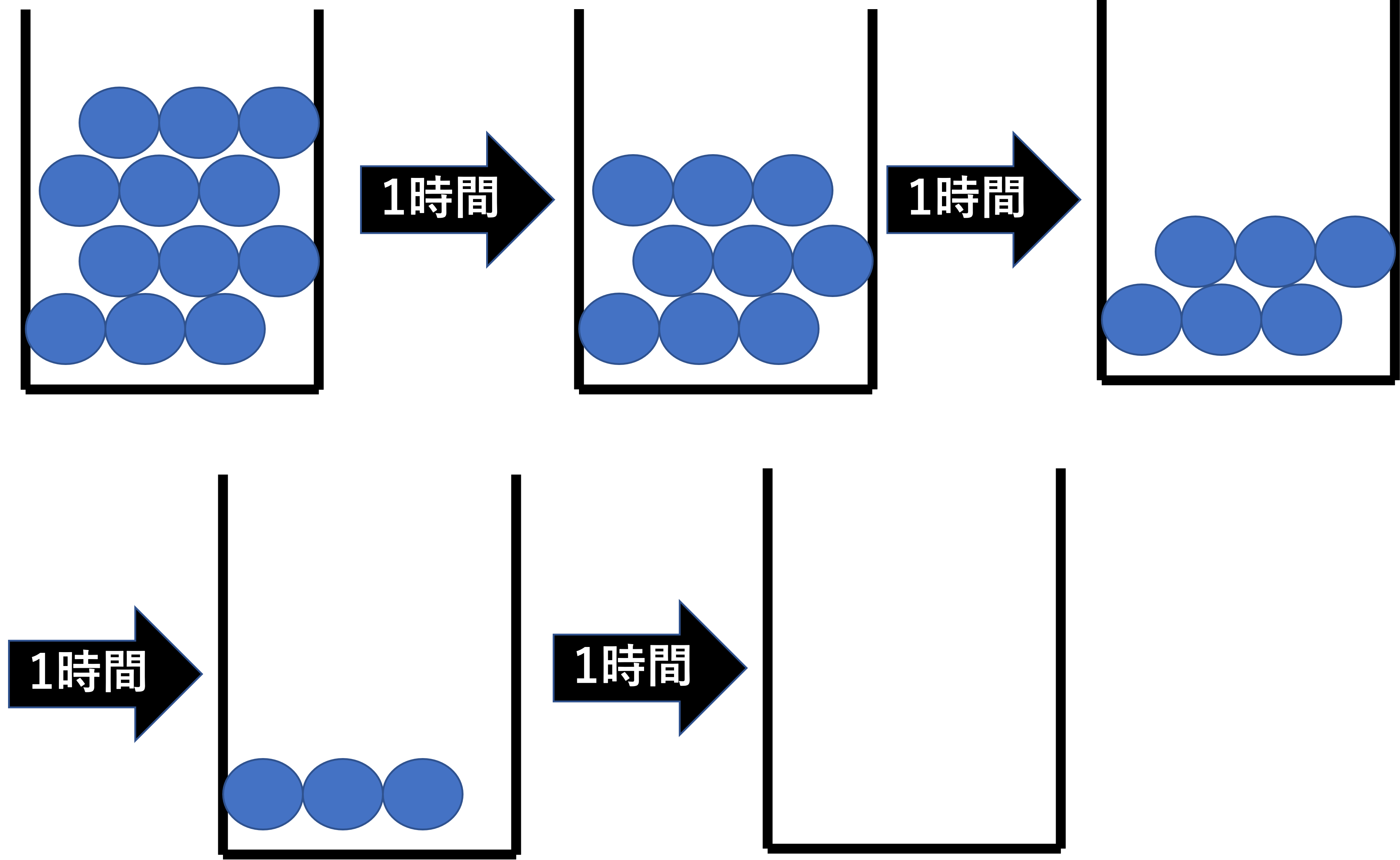
0時間(スタート)では、もちろん12個あります。1時間経過すると、3個減るので9個になります。
さらに1時間経過すると、また3個減るので6個になります。つまりスタート時点から考えると半減期は2時間となります。
そしてまた1時間経過すると、また3個減るので3個となります。そしてもう1時間経過すると、ついに0個になります。よってスタート時点から4時間経つことで薬が全て分解されることになります。
1次反応
1次反応では、常に一定の割合で分解します。1次反応といえば、SN1反応が代表例です。SN1反応は基質のみの濃度に依存する反応でしたね。
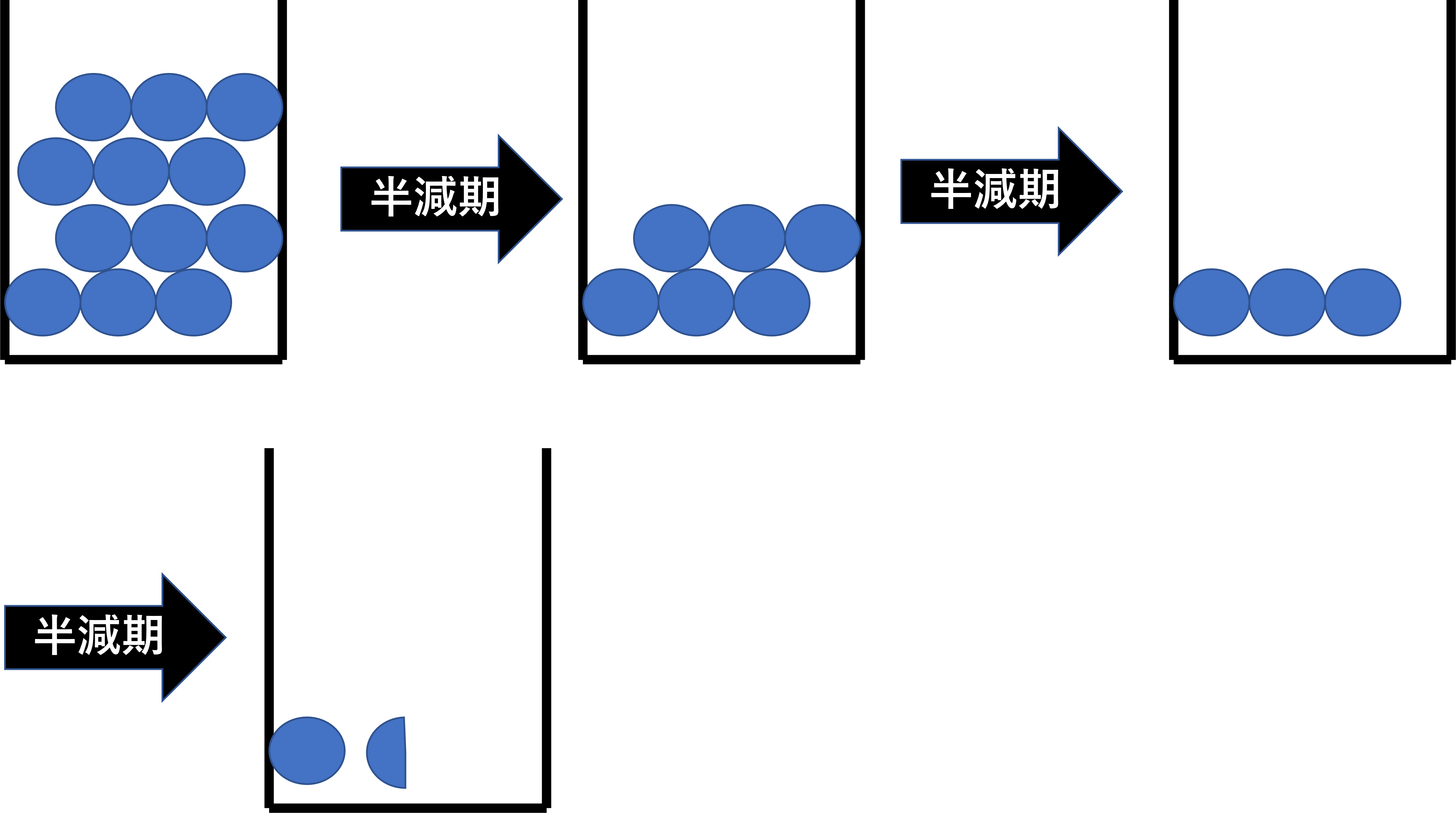
1次反応も同じく薬が全部で12固あった場合の例を見てみると
0時間(スタート)では12固あります。ここから半減期経過することで、半分になるので6個になります。
さらに、もう半減期経過すると半分になるので3個になり、またさらに半減期経つと1.5個となります。
2次反応
2次反応では、半減期は初濃度に反比例します。2次反応も代表例と言えばSN2反応です。SN2反応は基質と試薬に依存する反応でした。
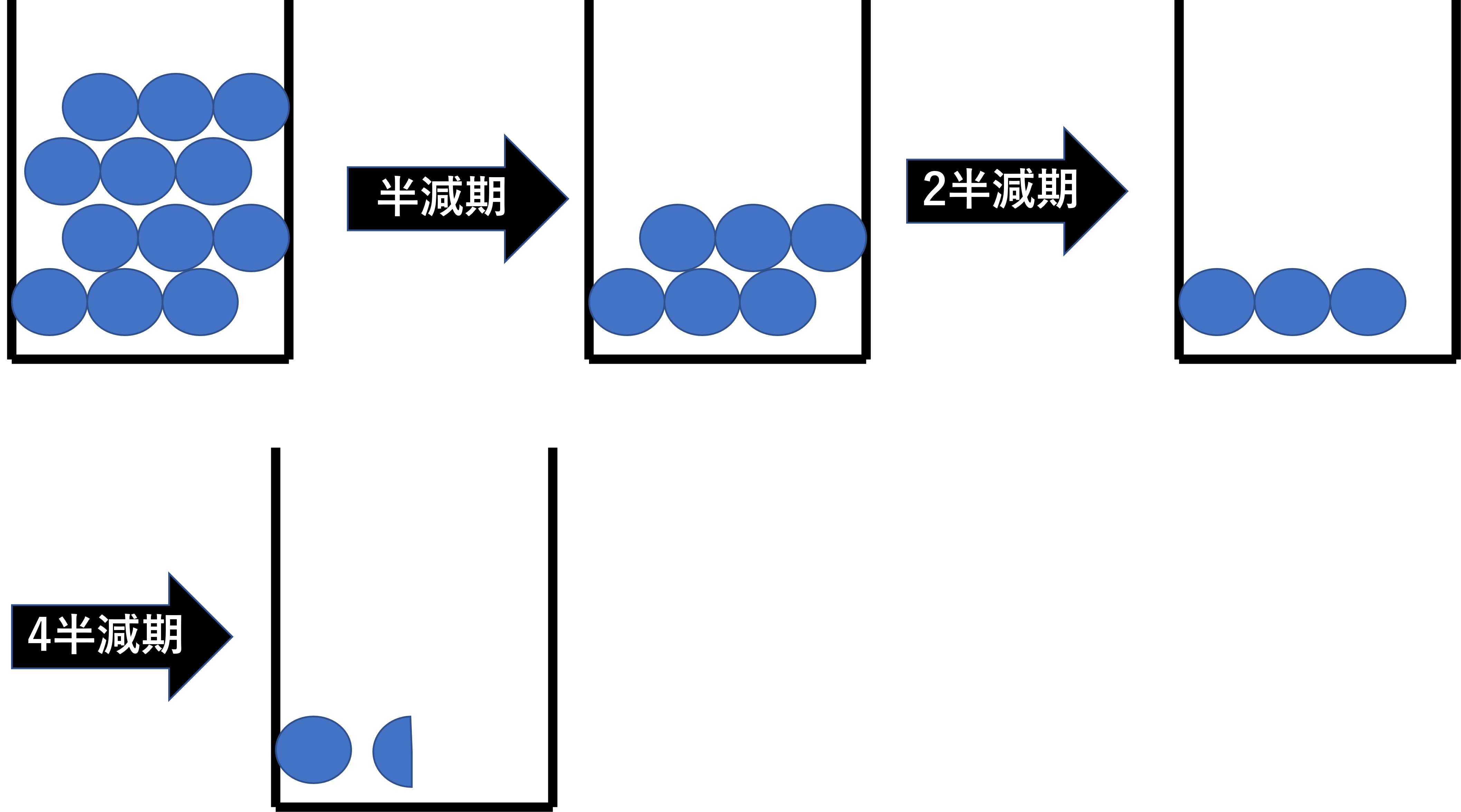
2次反応も同じく薬が全部で12個あった場合の例を見てみると
0時間(スタート)では12固あります。ここから半減期経過することで半分になるので6個になります。
そこからさらに3個になるには、2半減期時間がかかります。
それぞれの反応のイメージはわいたでしょうか?次回からは具体的な式などをもとにそれぞれの反応をみていきます。
まとめ
- 0次反応は、一定速度で分解していく反応。
- 1次反応は、一定割合で分解していく反応。
- 2次反応は、半減期は初濃度に反比例する。
