

Sponsored Link
双極子とファンデルワールス力
このカテゴリーでは、物理に関わるものを見ていきます。と言いましても、初回は化学寄りな内容で、分子間相互作用です。まず結合は以下の図のように分けられます。
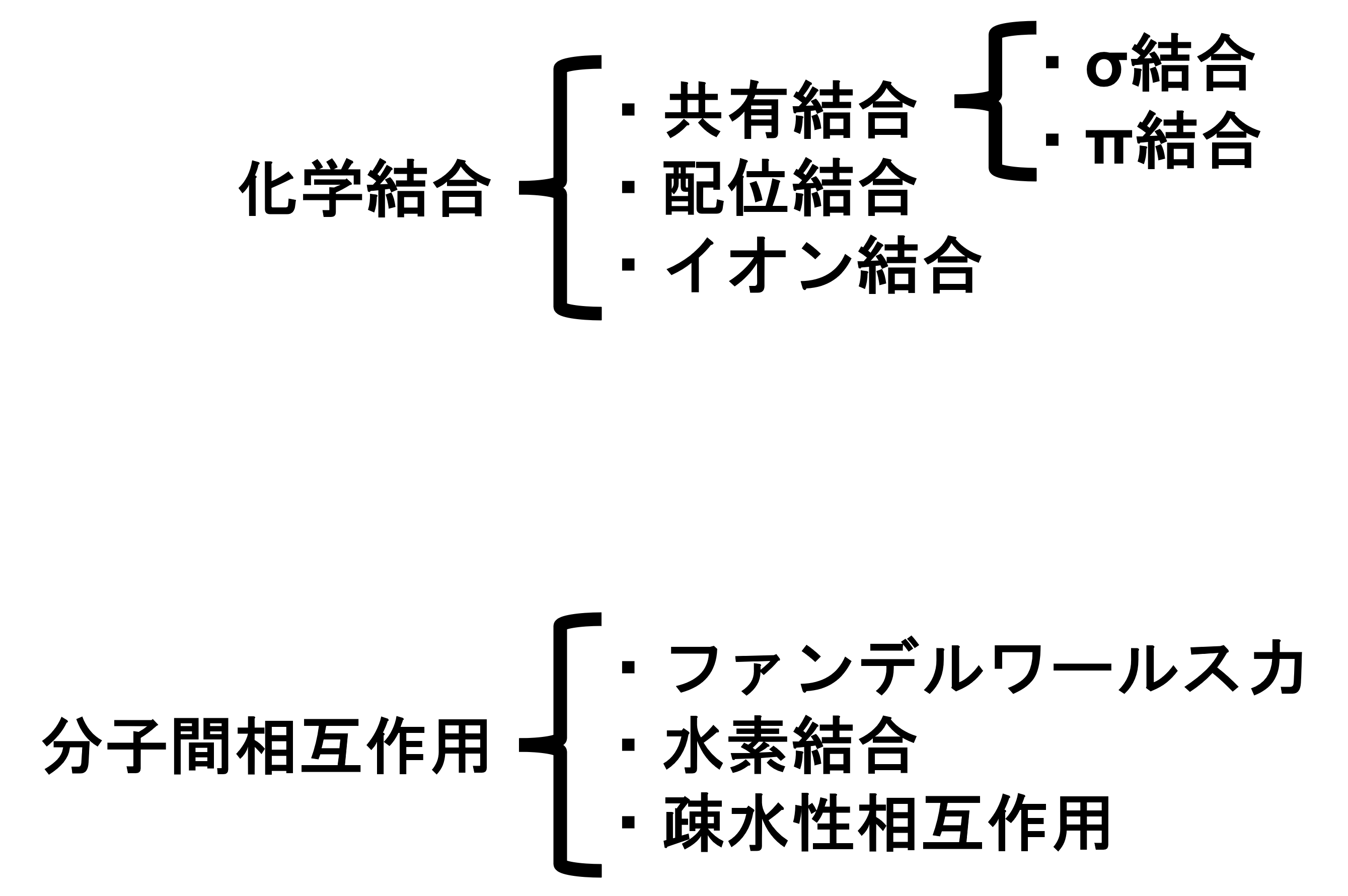
化学結合は結合力が大きいのに対して、分子間相互作用は結合力が小さいです。今回は分子間相互作用のうち、ファンデルワールス力について見ていきます。
Sponsored Link
Sponsored Link
電荷の偏り
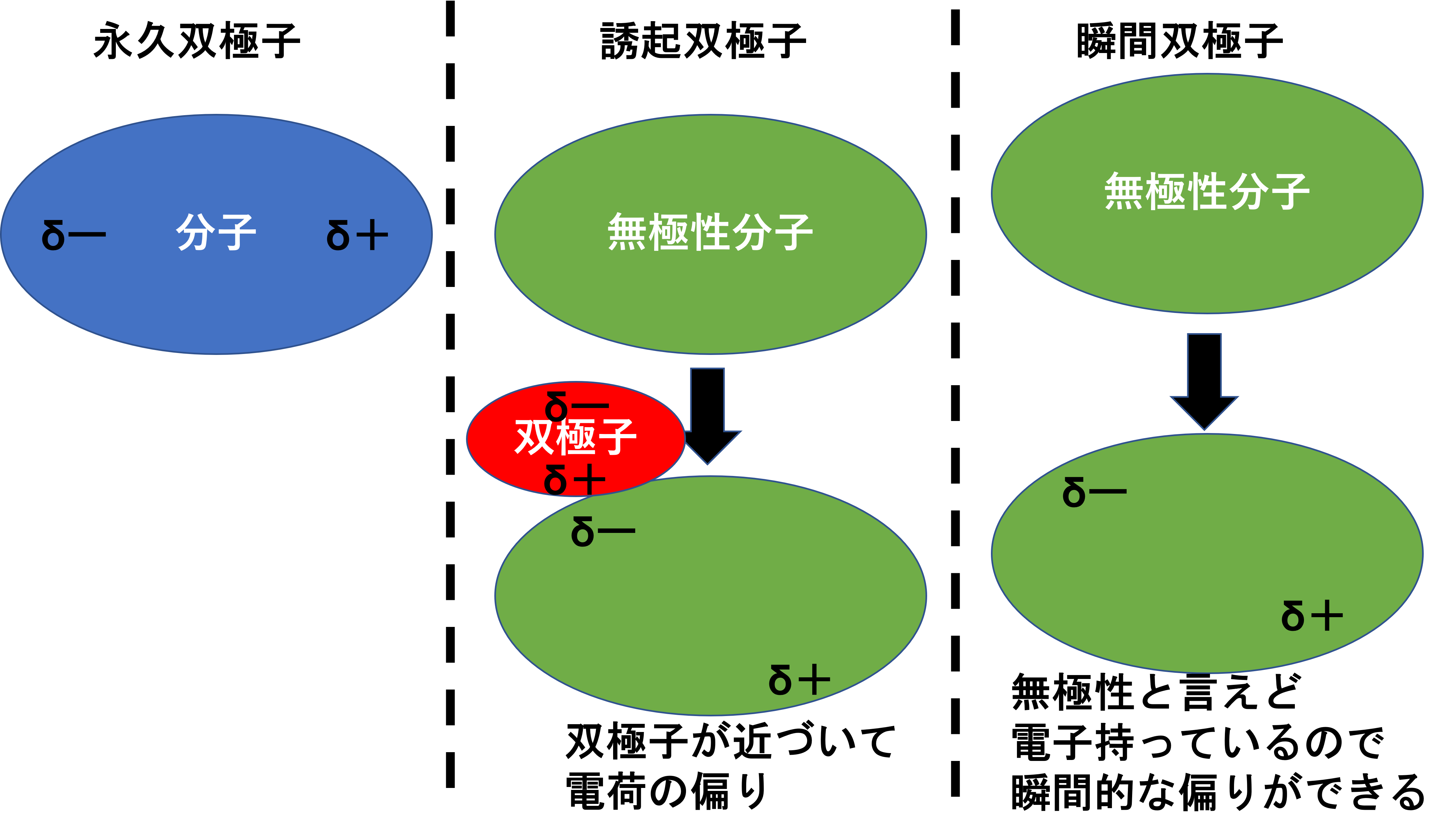
電気陰性度の異なる原子が共有結合すると、電子を引っ張る力によって原子間の電子密度に偏りが生じます。つまり電気陰性度の大きい原子は電子を引っ張るために部分的にマイナスが強くなり、これをδーで表します。逆に電子をとられた側はマイナスが減るためプラスとなり、これをδ+で表します。このように電荷の偏りができたものを双極子と呼び、以下のようなものがあります。
- 永久双極子;結合に関与する原子間の電気陰性度の差に起因する双極子
- 誘起双極子;周囲の環境が要因となり起こる電荷の偏りによって生じる双極子
- 瞬間双極子;電子運動により瞬間的に分子内の電荷分布が偏って生じる双極子
双極子間相互作用
先ほどのように分子の電荷が偏ると、分子同士互いに引き合うようになります。これを双極子間相互作用と言います。双極子間相互作用には以下のようなものがあります。
- 永久双極子-永久双極子間相互作用(keesom力)
- 永久双極子-誘起双極子間相互作用(Debye力)
- 瞬間双極子-誘起双極子間相互作用(London力)
永久双極子-永久双極子間相互作用(keesom力)
永久双極子同士による相互作用です。お互いが近づいたときに、一方の分子のδ+と、もう片方のδーが引き合って起こります。イメージとしては磁石と磁石です。

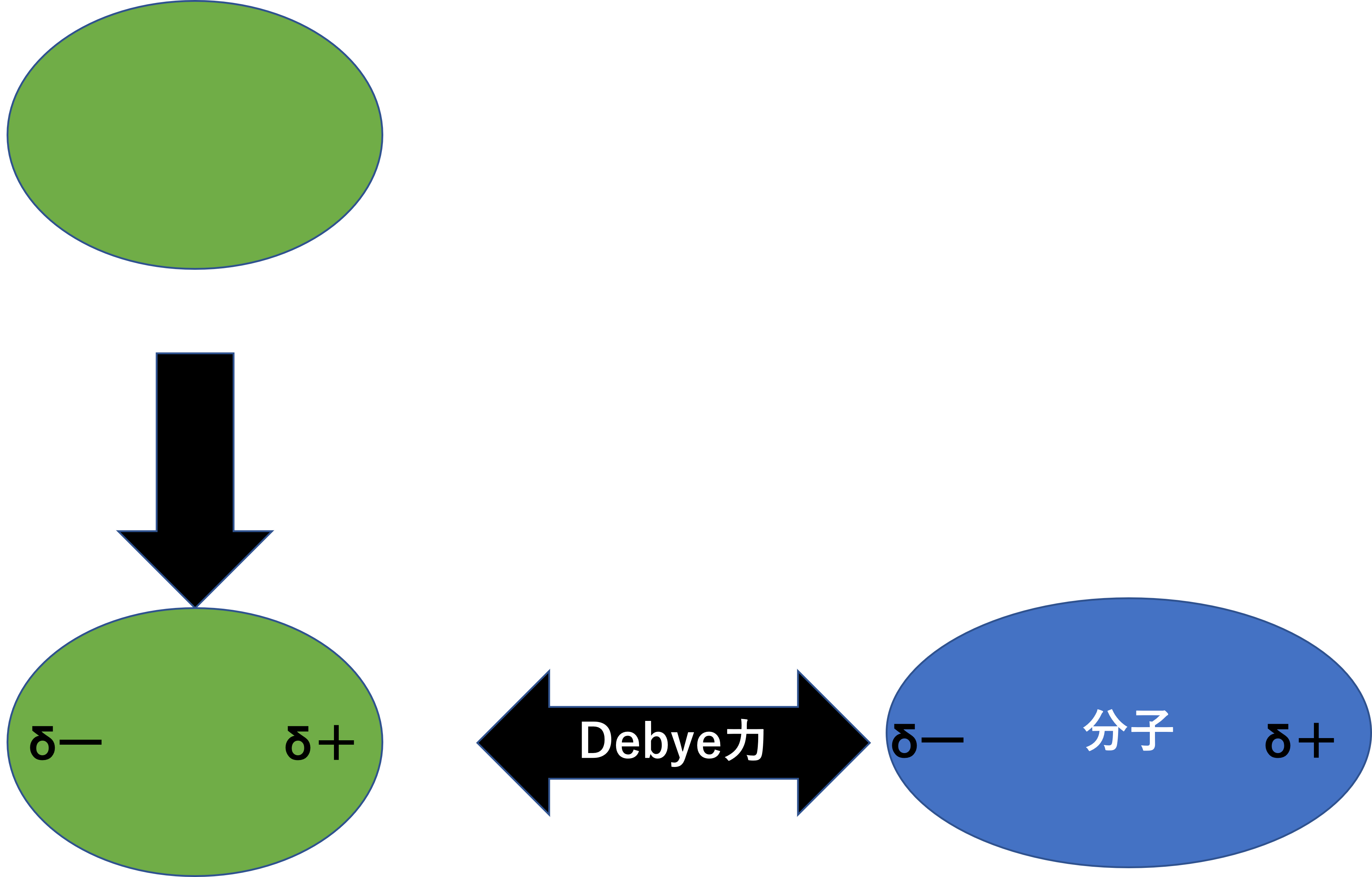
永久双極子-誘起双極子間相互作用(Debye力)
永久双極子と誘起双極子による相互作用です。イメージとしては磁石と鉄です。
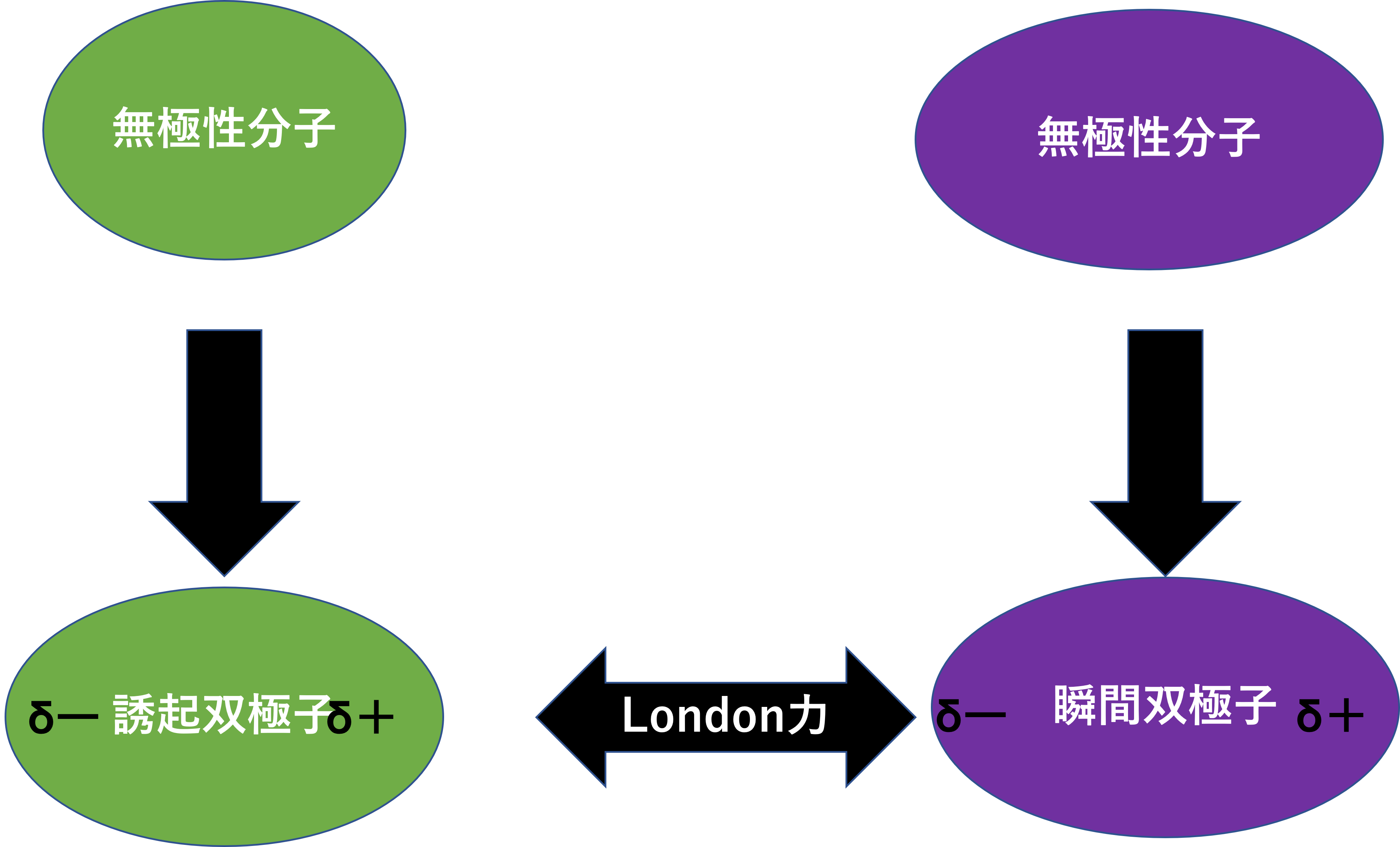
瞬間双極子-誘起双極子間相互作用(London力)
瞬間双極子と誘起双極子による相互作用です。次にお話しするファンデルワールス力はほとんどが、瞬間双極子-誘起双極子間相互作用(London力)となります。
ファンデルワールス力
ファンデルワールス力は電荷のない中性分子や原子に働く力を言います。原子や分子同士が近づくときにはある程度までは引力が働きますが、近づきすぎると今度は反発力が働きます。
ファンデルワールス力はヒトとの距離感と同じで、親しい人ならまだしも、知らない人だとほどよい距離感が心地よいということになります。つまり距離感が大事であり、ここでは式は割愛しますが、ファンデルワールス力の引力は分子間距離の6乗に反比例します。この分子間距離の「6乗」に反比例の覚え方としては「ファンデルワ」ールス力と伸ばし棒まで6文字あるのを印象づけて覚えましょう。
まとめ
- 電荷の偏りによって相互作用が発生する。
- ファンデルワールス力の引力は分子間距離の6乗に反比例する
