

Sponsored Link
質量スペクトルの読み方、例題編
前回の質量分析法の質量分析計と質量スペクトルでは、質量スペクトルの基本的なことを見ました。今回は質量スペクトルの読み方について例題を見ながら解いていきたいと思います。

さっそく例題にいきましょう!!
例題1
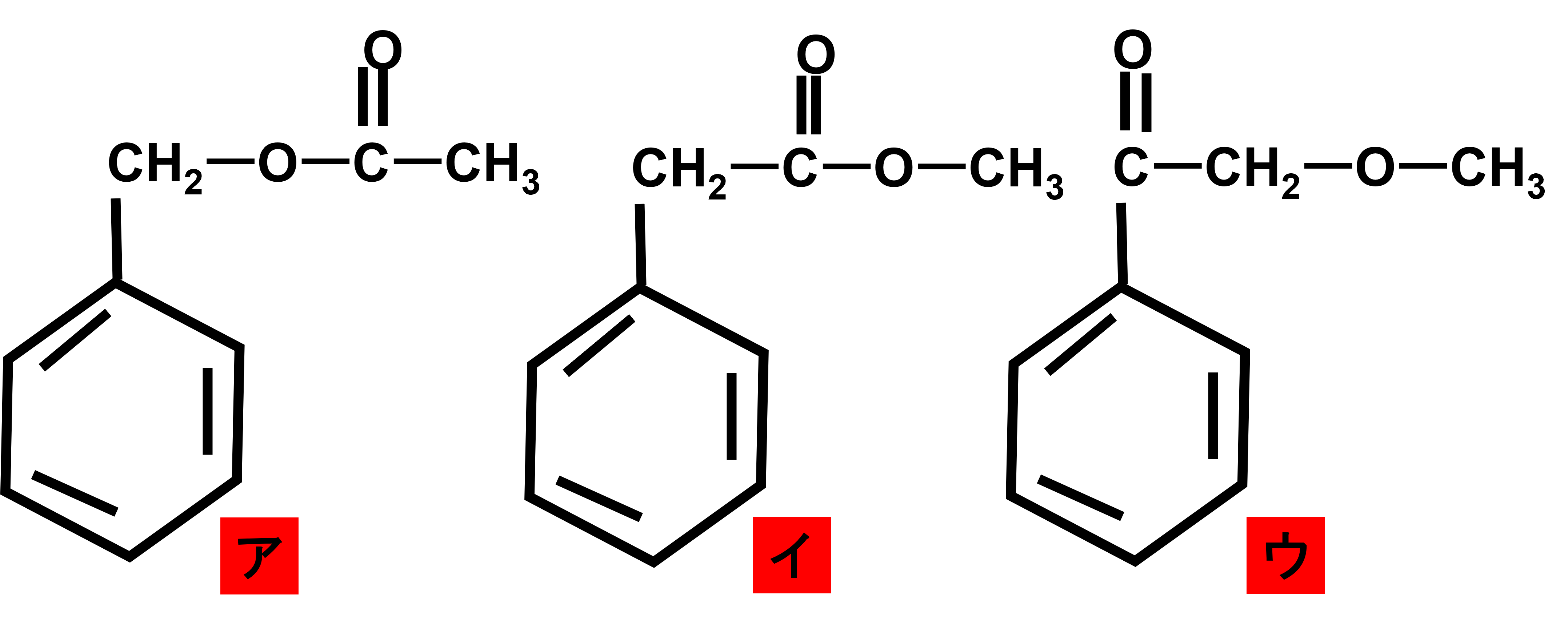
次の図は、C9H10O2の質量スペクトルである。この質量スペクトルは次のア〜ウのどれか?ただし、スペクトルの上に書いてある数字はm/zを表し、回答の判断に関係のない細かいピークは省略している。
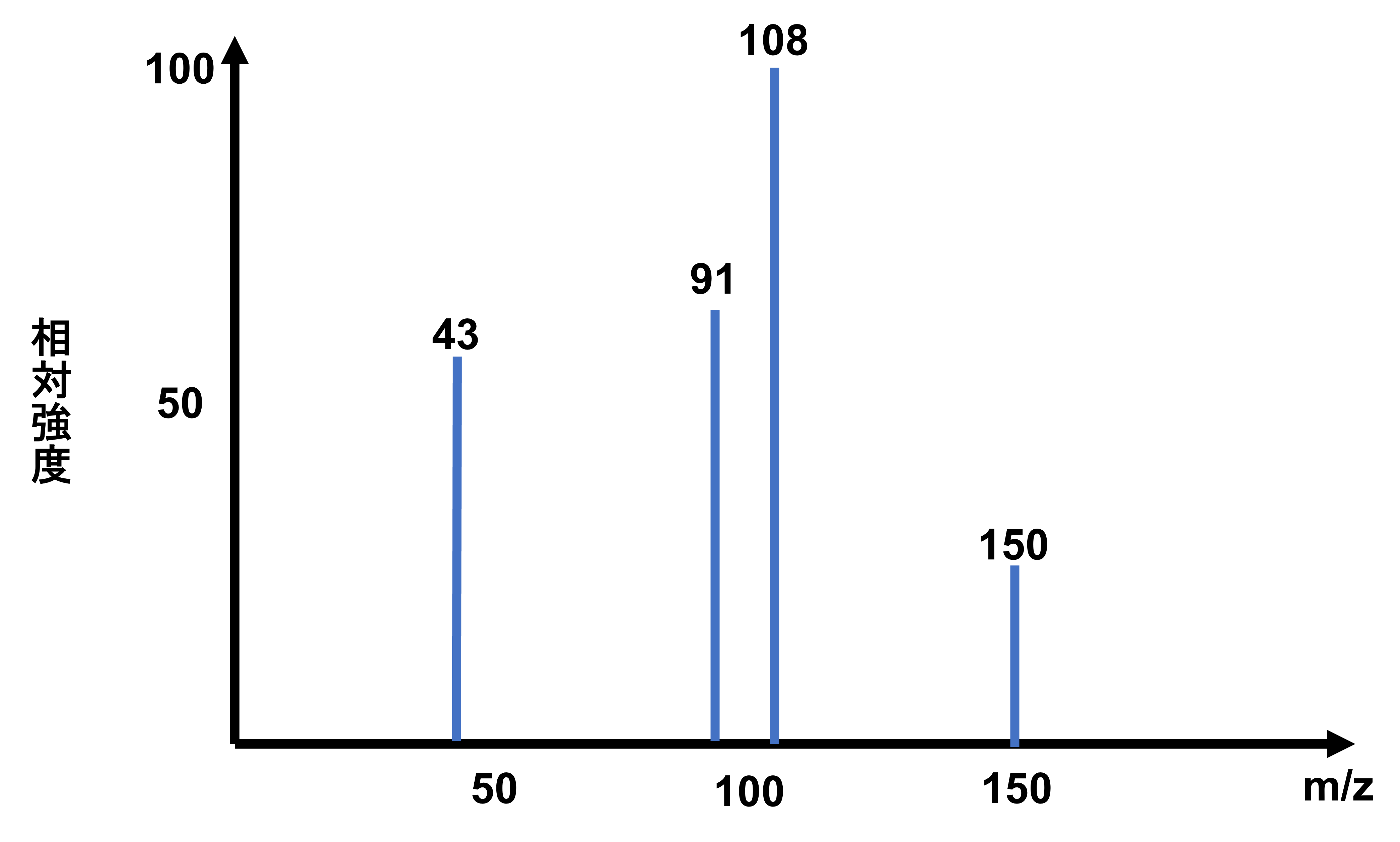
一置換ベンゼン誘導体ということでm/z77にピークがあります。77はC6H5というのは覚えておくと質量スペクトルでは役立ちます。そしてこれはア〜ウ全てに共通しているのでヒントにはなりません。
さて次に注目するべきはm/z43です。Cは12、H1、Oは16であり、43と奇数であることから、Hの部分は奇数個必要であることが推測できます。そこで選択肢ア〜ウまでを見てみると全てCH3が入っていることがわかります。ここからCH3の15を43から引くと、残りは28となります。再び選択肢ア〜ウの構造式のCH3の隣を見てみると、アのCOがちょうど28であるため、このことから答えはアと判断できます。
Sponsored Link
Sponsored Link
例題2
次の図は、以下のア〜オのいずれかの質量スペクトルである。この質量スペクトルはどの化合物の構造式か答えよ。ただし、スペクトルの上に書いてある数字はm/zを表し、回答の判断に関係のない細かいピークは省略している。

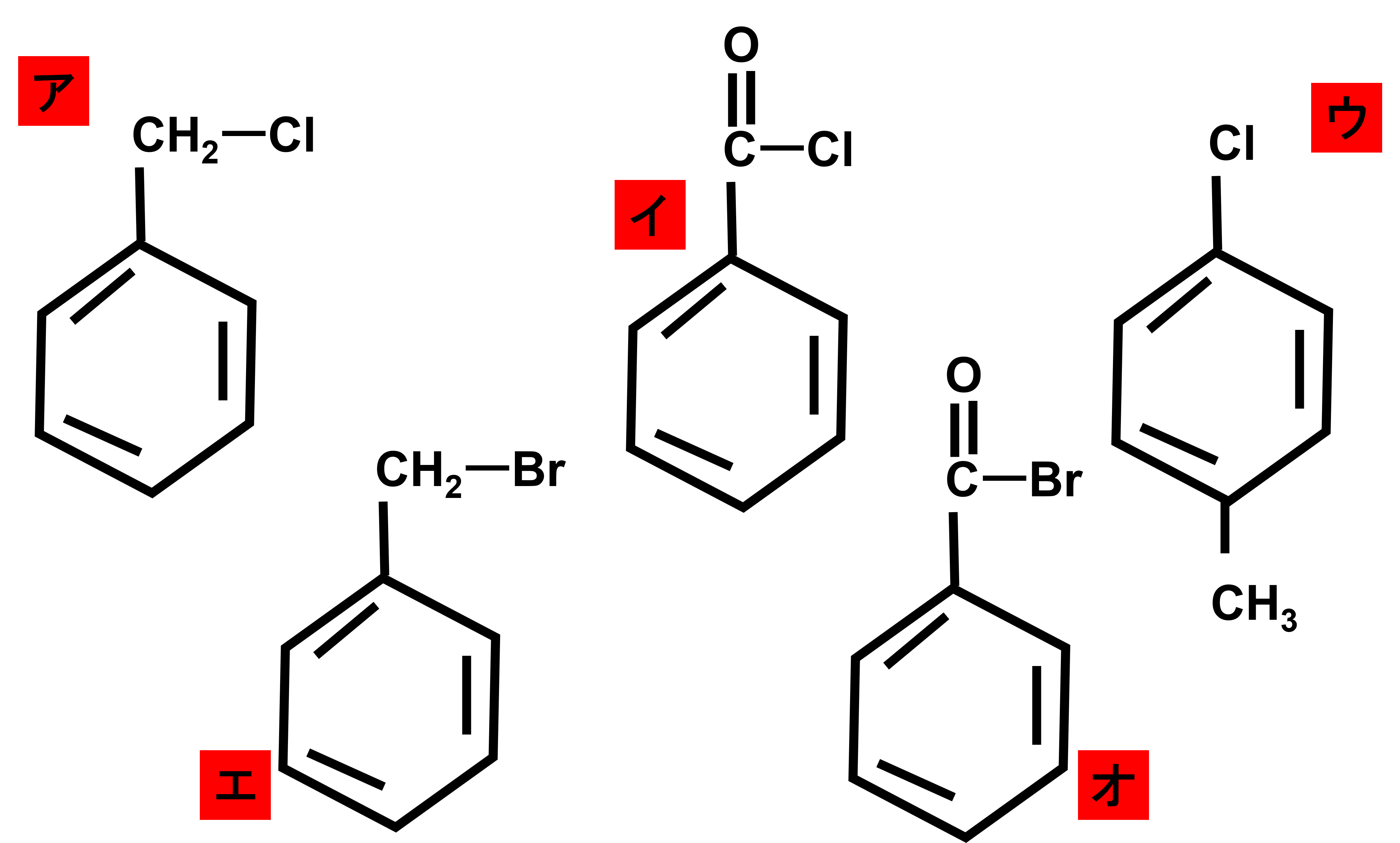
まず選択肢ア〜オを見てみると、全ての構造式に臭素(Br)や塩素(Cl)を含まれていることがわかります。そのため、臭素(Br)や塩素(Cl)を含む場合のルールをまず考えます。
分子イオンピークのところを見ると、強度比が約1:1のピークが現れています。これは臭素を含んでいるサインと読み取れるので、臭素を含むエかオのどちらかと判断することができます。
またその他にも分子イオンピークが170なので、エは170、オは184となるため、これだけでエが答えとわかってしまうのですが、せっかくなのでもう少し質量スペクトルを見てみましょう。
基準ピークは91です。これもエとオを比較してみると、それぞれC6H5とBrは一緒でそれ以外が違っています。エはC6H5CH2であり、これはm/z91です。またオはC6H5COであり、これはm/z105です。91にピークがあり、105にピークがないことからもエが答えであることがわかります。
以上より答えはエとなります。
質量スペクトルは例によって習うより慣れよなので、多くの問題を解いて身につけるようにしましょう。
まとめ
- 質量スペクトルは習うより慣れよ(笑)
