
実習生、新人薬剤師のための参考書

状態図の三重点では、固相、液相、気相の3つの状態が存在します。自由度(F)=成分の数(C)−相の数(P)+2で表されます。
Sponsored Link
状態図と自由度
物質は様々な状態をとり、そこにはエネルギーの出入りなども関わります。今回は状態図や自由度について見ていきたいと思います。
状態図とは
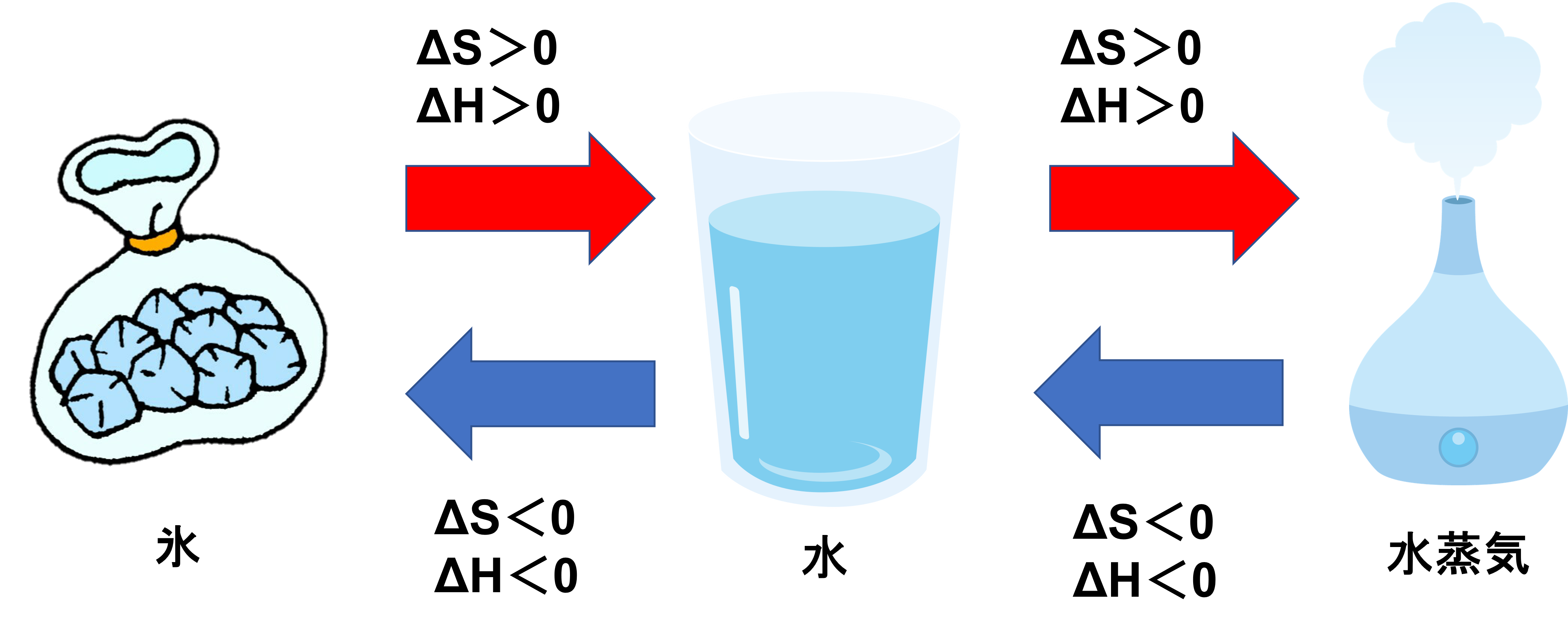
系の内部が化学的にも物理的にも均一で、他から区別、分離できるときその部分を相と言います。気体、液体、固体の相は、気相、液相、固相と言います。これらの相の移動にはエネルギーの出入りが必要になります。
これらの相と温度、圧力との関係性を表したものが状態図であり物質によって異なります。例えば、水や二酸化炭素では以下のような状態図をとります。

- AT;融解曲線。固相と液相が共存する
- BT;昇華曲線。固相と気相が共存する
- CT;蒸気圧曲線。液相と気相が共存する
- T;三重点。固相と液相と気相が共存する
- C;臨界点。臨界点以上の温度、圧力では超臨界流体とよばれる気体と液体両方の性質を持つような特殊な状態となる。
Sponsored Link
Sponsored Link
自由度とは
自由度とは平衡状態にある相の数を変えることなく、独立に変えることができる状態変数の数を表しています。自由度の式は以下のように表されます。
- 自由度(F)=成分の数(C)−相の数(P)+2
ここで自由度の式を覚えるゴロを紹介します。
- ふくまっぷたつー

- ふ;F
- く;C
- まっ;マイナス
- ぷ;P
- た;足す(プラス)
- つー;2
イメージ作りの物語を語るまでもないですね。服が真っ二つになってしまったということです。服が真っ二つで思い出されるのはセンターマ〇ですね。おそらくこの記事を読んでいる薬学生の方はセンターマ〇知らないと思うので、気になる方はググってください(笑)
状態図では自由度は以下の3つのパターンがあります。
- 固相、液相、気相のうち、どれかの相で存在している時
- 融解曲線、昇華曲線、蒸気圧曲線のうち、どれかの曲線上に存在している時
- 三重点に存在している時
固相、液相、気相のうち、どれかの相で存在している時
成分は1つなのでC=1、相は固相、液相、気相のうちどれかなのでP=1となります。これを代入して、自由度は2となります。
融解曲線、昇華曲線、蒸気圧曲線のうち、どれかの曲線上に存在している時
成分は1つなのでC=1、相は曲線上では2つの相が存在しているのでP=2となります。これを代入して、自由度は1となります。
三重点に存在している時
成分は1つなのでC=1、相は三重点では固相、液相、気相の3つの相が存在しているのでP=3となります。これを代入して自由度は0となります。
まとめ
- 状態図の三重点では、固相、液相、気相の3つの状態が存在する。
- 自由度(F)=成分の数(C)−相の数(P)+2
