

Sponsored Link
擬1次反応、特殊酸触媒と特殊塩基触媒
前回の擬0次反応の式とグラフ、例題編では擬0次反応について見ました。今回は擬1次反応について見ていきたいと思います。

擬1次反応
前回の擬0次反応同様、本当は2次反応ですが、1次反応のマネをするものを擬1次反応と言います。擬1次反応の代表例にはアスピリンなどのエステルの加水分解があります。
アスピリンなどのエステルは水溶液中で加水分解されますが、これには酸や塩基が触媒として働きます。特にH+や−OHの触媒による反応を特殊酸塩基触媒反応と言います。
pHプロファイル
先ほどの特殊酸塩基触媒反応のように、みかけの分解速度定数kの対数とpHとの関係をプロットしたものをpHプロファイルと呼び様々な形をとります。ここでは基本的な3つについて見ていきます。
- 特殊酸触媒の影響を受ける医薬品
- 特殊塩基触媒の影響を受ける医薬品
- 特殊酸触媒と特殊塩基触媒の影響を受ける医薬品
特殊酸触媒の影響を受ける医薬品
先ほどのアスピリンを例で、kHを酸触媒定数とすると
−dC/dt=kH・[H+]・C(アスピリン)
k=kH・[H+]とすると
−dC/dt=k・C(アスピリン)となり見かけ上、1次反応になります。
さて、k=kH・[H+]が成り立つため、これのlogをとると、
logk=logkH+log[H+]
pH=−log[H+]であるため、
logk=−pH+logkHとなります。
つまり縦軸をlogk、横軸をpHのpHプロファイルは傾きが−1となります。

特殊塩基触媒の影響を受ける医薬品
特殊酸触媒と同様に考えると、
k=kOH・[−OH]
logk=kOH+log[−OH]
Kw=[H+]・[−OH]が成り立つため
logk=logkOH+logKw/[H+]
logk=logkOH+logKw−log[H+]
logk=pH−pKw+logkOHとなります。
つまり縦軸をlogk、横軸をpHのpHプロファイルは傾きが+1となります。

特殊酸触媒と特殊塩基触媒の影響を受ける医薬品
特殊酸触媒と特殊塩基触媒の影響を受ける医薬品では今までの2つの合わせ技になります。k=kH[H+]+kOH[−OH]で表されて、pHが低い領域では特殊酸触媒が作用し、pHが高い領域では特殊塩基触媒が作用します。
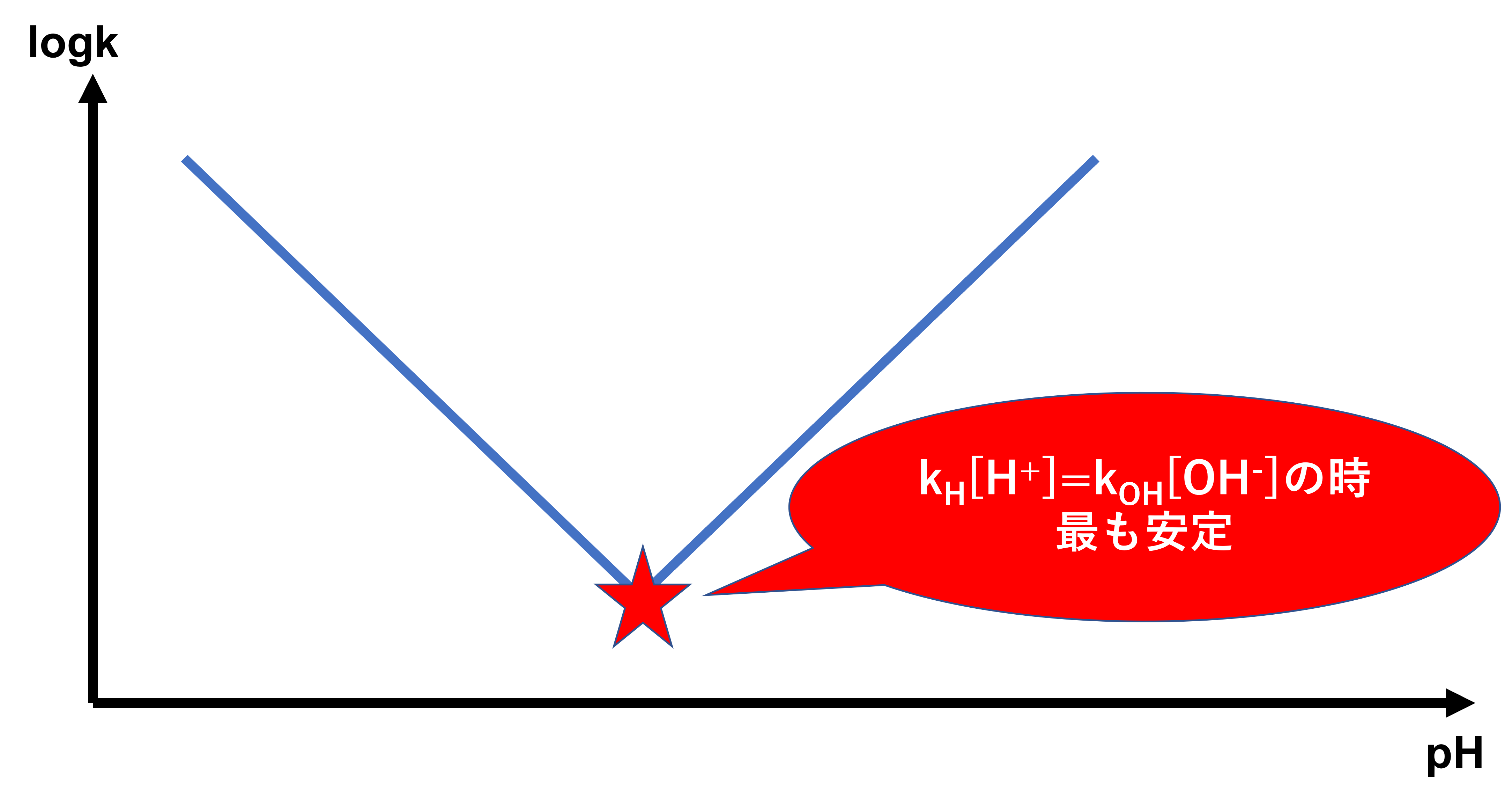
このグラフからもわかるようにkH[H+]のグラフと、kOH[−OH]のグラフが交わるところが、kが一番小さくなり分解されにくいとも言えます。よってkH[H+]=kOH[−OH]の時が最も安定しているということができます。
では例題を見てみましょう。
Sponsored Link
Sponsored Link
例題1
ある薬は、特殊酸触媒と特殊塩基触媒の影響を受け、k=kH[H+]+kOH[−OH]で分解される。kH=1.0×10^2L/(mol・h)、kOH=1.0×10^4L/(mol・h)とすると、この薬を最も安定に保存できるpHはいくらか答えよ。
先ほどのkH[H+]=kOH[−OH]の時が最も安定しているということを利用します。
1.0×10^2[H+]=1.0×10^4[−OH]
[H+]=1.0×10^2[−OH]
[H+]=1.0×10^2・1.0×10^−14/[H+]
[H+]^2=1.0×10^−12
[H+]=1.0×10^−6
よってpH=6。これが答えです。
まとめ
- 特殊酸触媒と特殊塩基触媒の影響を受ける医薬品では、kH[H+]=kOH[−OH]の時が最も安定となる。
