

Sponsored Link
薬機法、再審査と再評価の違い
前回の薬機法、製造販売の承認では医薬品や医療機器などの承認についてみました。今回は薬機法における再審査や再評価についてみていきたいと思います。
再審査とは
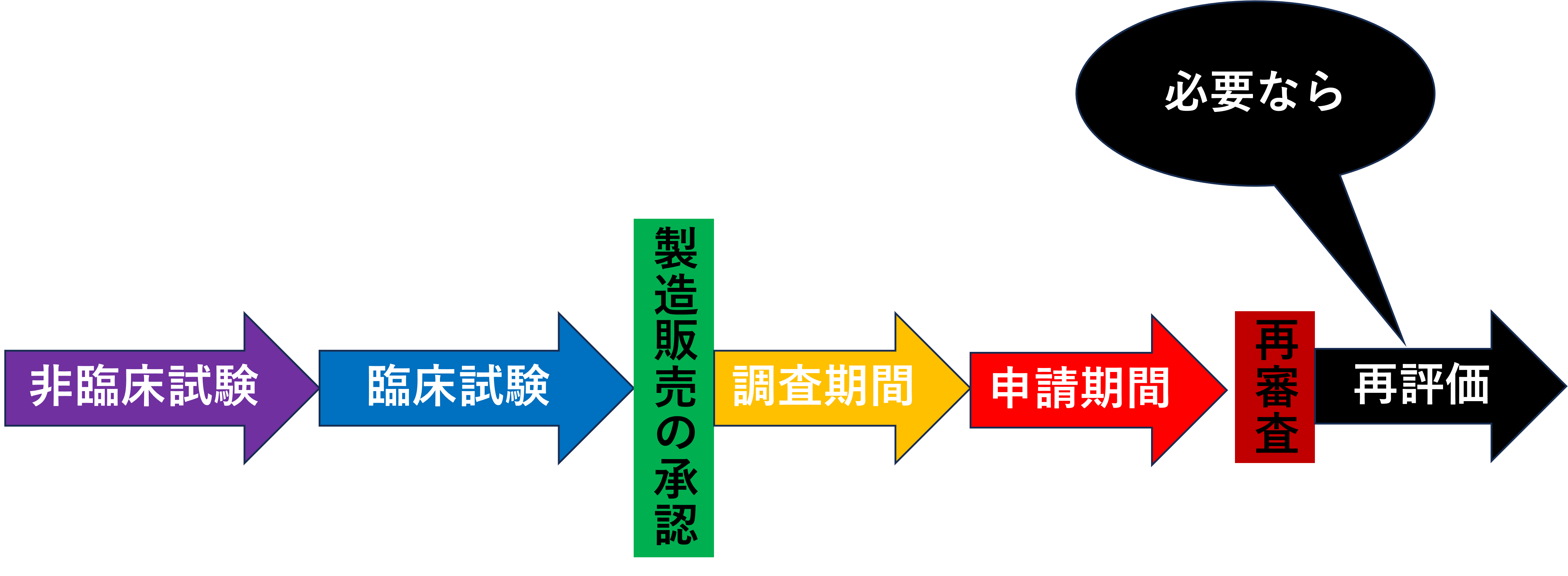
再審査の前に新医薬品を例に、市場に出回るまでの流れを見ましょう。
非臨床試験で動物などでデータを集めて問題なければ、臨床試験でヒトに対するデータを集めます。そしてヒトでも問題なければ、前回やった製造販売の承認を行い市場に出回ります。
新医薬品は承認を受けていると言えど、そのまま漠然と使い続ければよいというわけではありません。なぜならば臨床試験でデータを集めているといえど、そのデータ数は少なく、投与期間も短く、患者の年齢や併用薬などの観点などからも十分なデータ数がまだ集まっていないと言えるからです。
そのため製造販売後も新医薬品の安全性情報などを収集することは重要なことであり、製造販売後に定められた期間、品質、有効性、安全性などの情報を集めることには大きな意味があります。
Sponsored Link
Sponsored Link
よって厚生労働大臣が指定した新医薬品や新医療機器はその調査期間終了後に、その期間に集めた資料をもとに再び審査を受ける必要があります。これを再審査と呼び薬機法で定められています。
再審査は医薬品の製造販売後の調査及び試験の実施の基準に関わる省令(GPSP;Good Post-Marketing Study Practice)を順守して行われます。GPSPにおいて、製造販売業者は製造販売後調査等に関する業務を統括する者(製造販売後調査等管理責任者)を置き、管理責任者がつくった計画書に従って調査や試験を実施することが定められています。
再審査の申請期間は調査期間終了後に3か月以内に行わなくてはなりません。
再評価
再審査が終わり、市場に出回っている医薬品や医療機器に対して、厚生労働大臣が承認事項に適合しているかをGPSPに沿って集めた資料をもとに評価することを再評価と言います。
再審査は新医薬品や新医療機器が対象でしたが、再評価は全ての医薬品や医療機器が当てはまります。また、再審査は一度のみ行われますが、再評価は何度も行われます。
再審査と再評価と名前が似ていてややこしいですが違うものなので、しっかりとおさえましょう。
まとめ
- 新医薬品や新医療機器は調査期間終了後に、再審査を受ける必要がある。
- 再審査はGPSPを順守して行われ、調査期間終了後に3か月以内に行われなければならない。
- 再評価は全ての医薬品や医療機器が当てはまり、何度でも行われる。
