

Sponsored Link
ハロゲン化アルキル、SN1反応とSN2反応
前回の芳香族の反応3、求核置換反応とsandmeyer(ザンドマイヤー)反応では芳香族のsandmeyer(ザンドマイヤー)反応を見ました。今回はハロゲン化アルキルの求核置換反応について見ていきたいと思います。

ハロゲン化アルキル
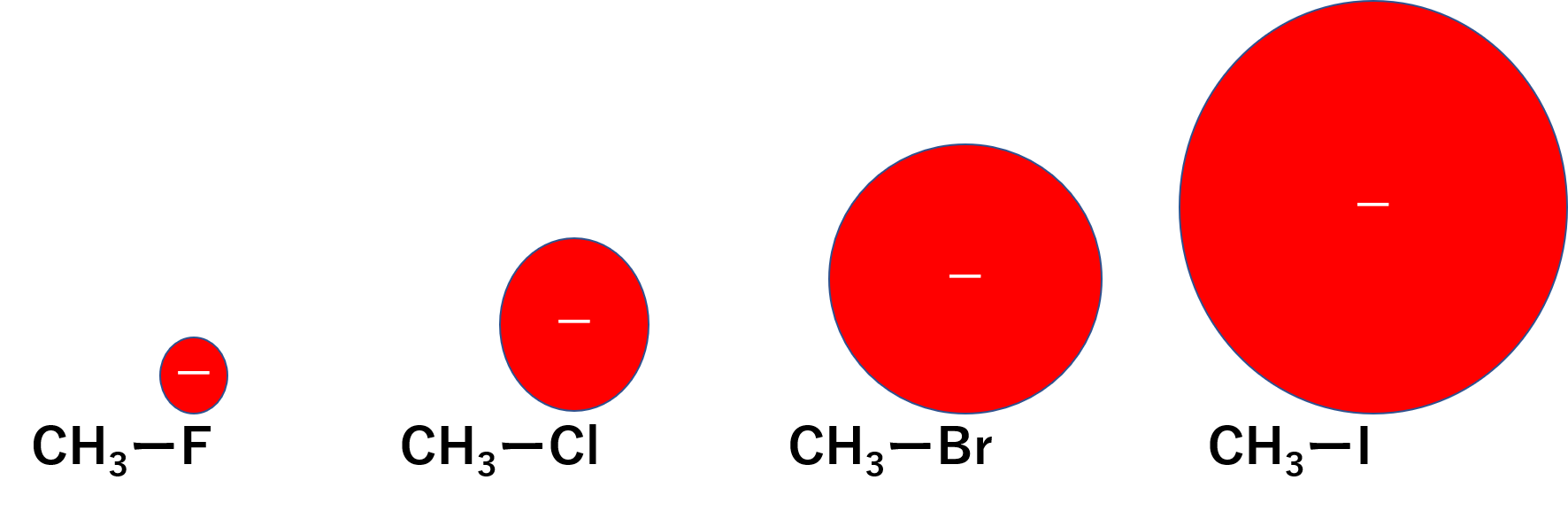
ハロゲンにはF、Cl、Br、Iなどがあるかと思います。これらがメチル基と結合したものをハロゲン化アルキルの例として考えてみましょう。
ハロゲンは電気陰性度が大きいため、ハロゲン化アルキルの炭素はプラス寄りで、ハロゲンはマイナス寄りとなります。よって、求核試薬とハロゲン化アルキルは反応しやすいです。この時それぞれのハロゲン化アルキルの反応のしやすさを比べると、
- F<Cl<Br<I
となります。これは脱離するハロゲン化物イオンの安定性で決まります。例えば、Fは電気陰性度が大きく密度が濃いのでがっちり結合するイメージです。逆にIはハロゲンの中では電気陰性度が小さく、電子が分散していてゆるく結合しているイメージを持ってもらえるとわかりやすいかと思います。
ハロゲン化アルキルの求核置換反応(Nucleophilic Substitution)は以下の大きく2つに分けられます。
- SN1反応;一分子的求核置換反応
- SN2反応;二分子的求核置換反応
Sponsored Link
Sponsored Link
SN1反応;一分子的求核置換反応
SN1反応は、日本語訳のように、律速段階において反応基質のみが関与する1分子的な求核置換反応で、以下のように進みます。
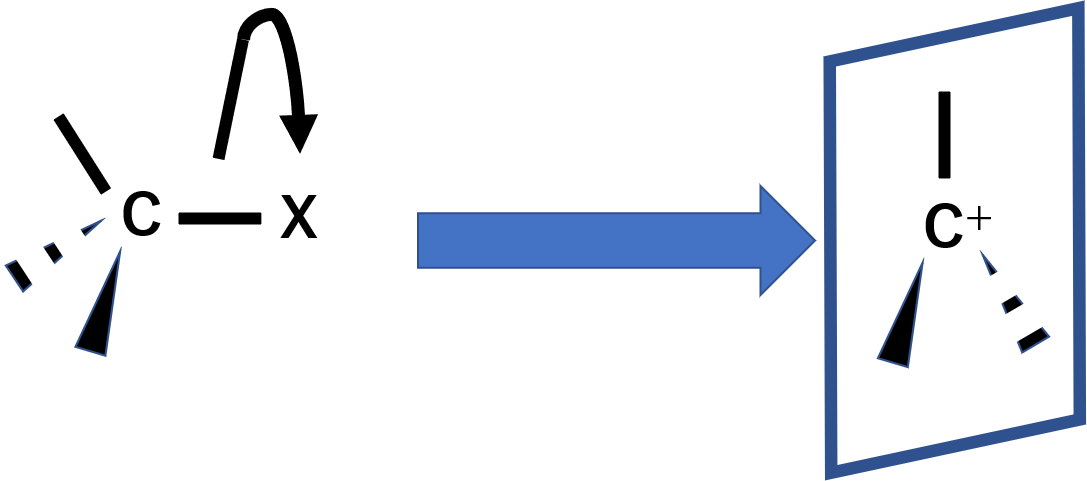
まず脱離基が取れ、カルボカチオンができます。この時、全ての置換基が1つの面に存在する形となります。
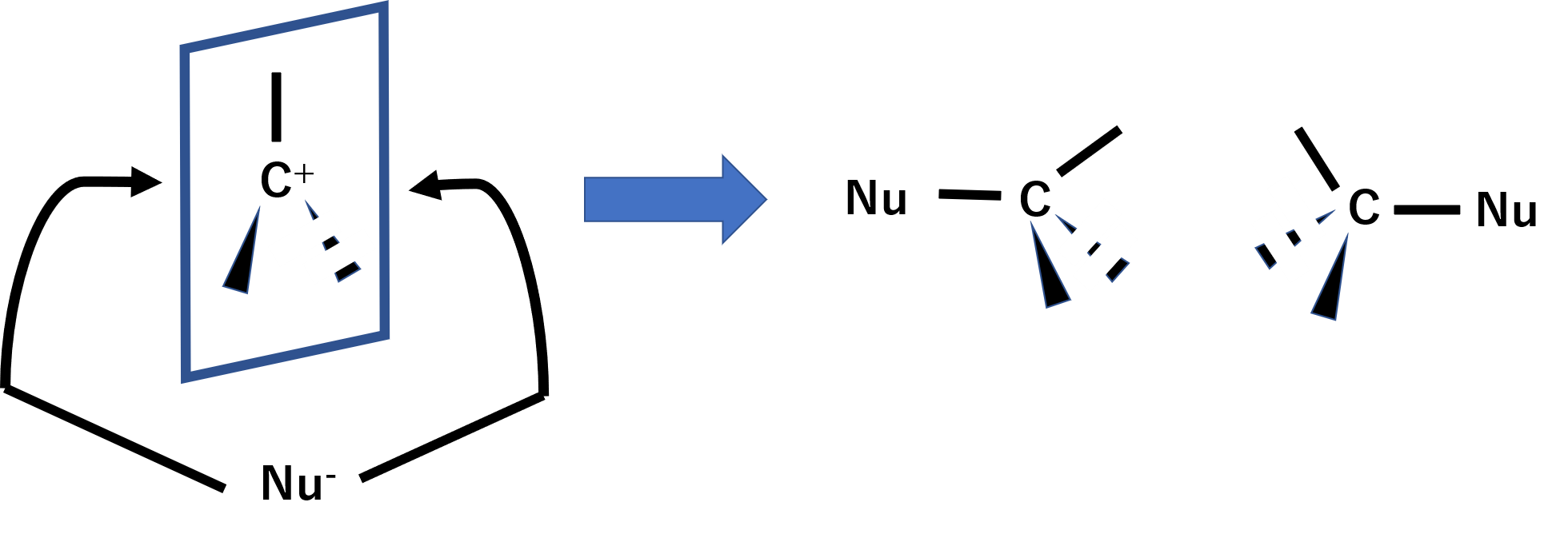
次にカルボカチオンに求核試薬が攻撃します。求核試薬は面に対して両側から攻撃できるため、ラセミ化しやすくなります。
SN1反応の1で混同することがありますが、注意するべきなのは2段階で反応が進むということです。あくまでSN1反応の1は律速段階が反応基質のみであるということを意味し、反応速度は反応基質の濃度のみ依存します。
SN1反応はカルボカチオンを経由するため、第一級カルボカチオンより安定な第三級カルボカチオンの方が起こりやすくなります。
SN2反応;二分子的求核置換反応
SN1反応に対して、SN2反応は反応速度は反応基質と求核試薬の濃度に依存し、以下のように進みます。

脱離基の反対側から求核試薬が攻撃して、同時に脱離基が抜けます。よって立体配置が反転します。
求核試薬が攻撃する時に、混雑していると攻撃しにくいですから、SN2反応は、第三級カルボカチオンより第一級カルボカチオンの方が起こりやすくなります。
まとめ
- SN1反応は律速段階は反応基質のみに依存し、ラセミ化しやすく、第三級カルボカチオンが有利
- SN2反応は律速段階は反応基質と求核試薬に依存し、立体反転しやすく、第一級カルボカチオンが有利
