

Sponsored Link
活性化エネルギーと反応エンタルピー
世の中結果が大事と言われますが、それには多くの過程を経て結果が出てきます。反応も同じく様々な状態を経て最終的な結果となります。今回は反応経路について見ていきます。

遷移状態
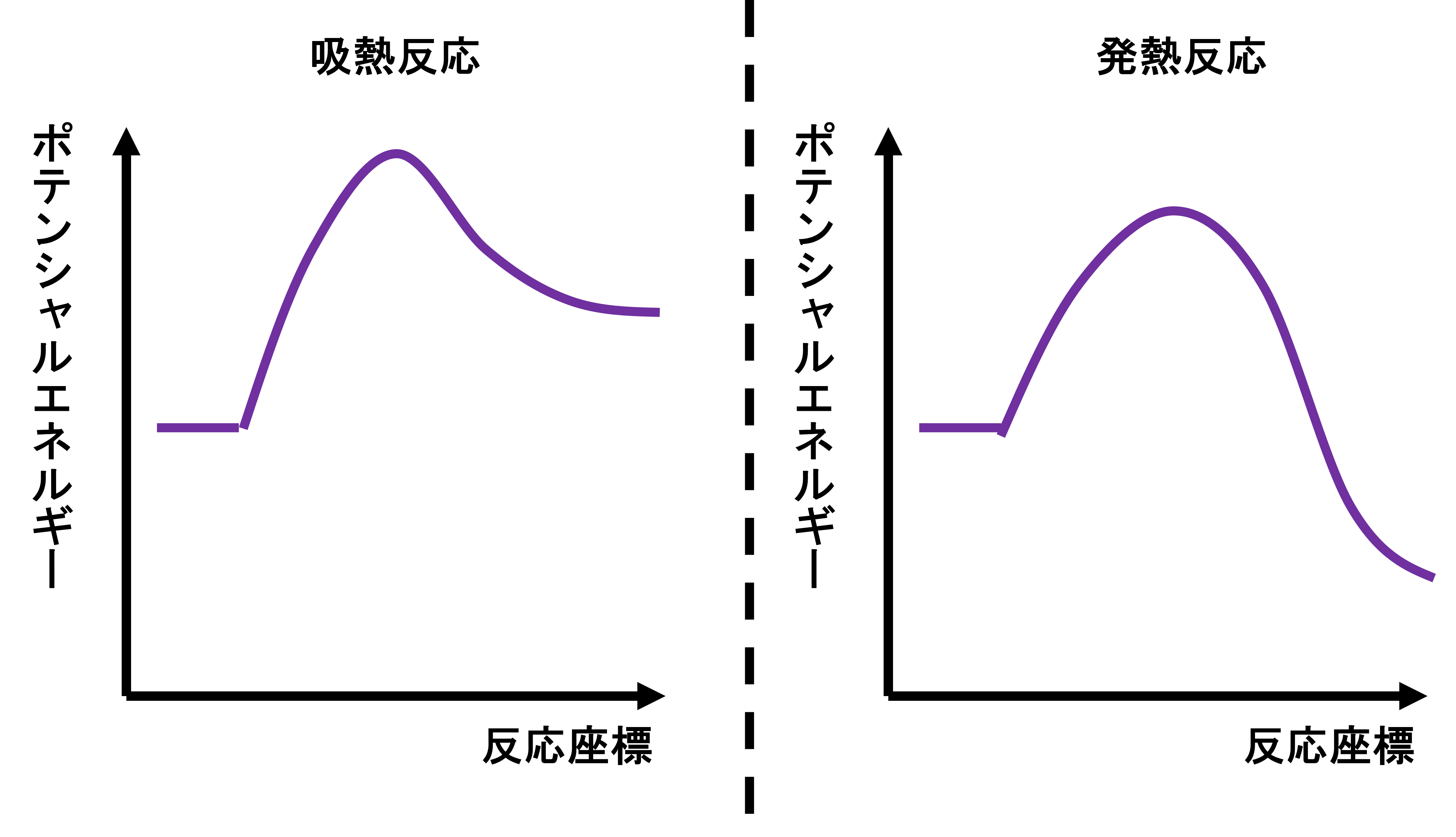
Aと言う物質とBと言う物質が反応して、Cと言う物質ができたとします。この反応において、いきなりCになるわけではなく、その中間である遷移状態と呼ばれる状態を経由してCになります。遷移状態の物質はエネルギーが高く不安定な状態となっています。
反応前の系のもつエネルギーと、遷移状態のエネルギーとの差を活性化エネルギー(Ea)と呼びます。活性化エネルギーは山登りと同じです。山登りは高い山の方が険しく登るのが大変で、逆に低い山の方が簡単に登れます。つまり活性化エネルギーが大きい(山が高い)ほど反応が進みにくく、活性化エネルギーが小さい(山が低い)ほど反応が進みやすいと言えます。

そして、反応前と反応後の系のエネルギー差は反応エンタルピー又は反応熱と呼ばれます。これに関しても反応前と比べて反応後の方がエネルギーが低い場合には、その差に相当するエネルギーを失っているわけですから発熱反応となります。逆に反応後のエネルギーが高い場合には、その差に相当するエネルギーをたくわえているわけですから吸熱反応となります。
触媒
触媒はそれ自身が化学的に変化することはなく、反応速度に影響を与える物質です。つまり触媒は活性化エネルギーに影響を与えて、反応エンタルピーには影響を与えない物質ともいうことができます。
正触媒を使った場合は活性化エネルギーが小さくなり反応速度が速くなります。負触媒を使った場合は活性化エネルギーが大きくなり、反応速度が遅くなります。
では国試風の例題を見てみましょう。
Sponsored Link
Sponsored Link
例題
反応速度に関する下図について以下の問いに答えよ。

- 活性化エネルギーが大きいほど、いずれの温度においても反応速度定数は大きくなる
- 正触媒を加えると反応エンタルピーは小さくなる
- 正触媒を加えると活性化エネルギーは小さくなる
- この反応は発熱反応である。
活性化エネルギーが大きいほど、いずれの温度においても反応速度定数は大きくなる
×。活性化エネルギーが小さくなるほど反応速度が速くなります。
正触媒を加えると反応エンタルピーは小さくなる
×。触媒が影響を与えるのは活性化エネルギーなので、反応エンタルピーには影響を与えません。
正触媒を加えると活性化エネルギーは小さくなる
〇。正触媒は活性化エネルギーを小さくして、反応速度が速くなります。
この反応は発熱反応である。
〇。反応前の系より反応後の系の方がエネルギーが低くなっているので、発熱反応です。
まとめ
- 活性化エネルギーが大きいほど反応が進みにくく、活性化エネルギーが小さいほど反応が進みやすい
- 触媒は活性化エネルギーに影響を与えて、反応エンタルピーには影響を与えない
