
実習生、新人薬剤師のための参考書

液液平衡の状態図において、曲線の内側だと2相、曲線の外側だと1相になります。液液平衡の状態図において、高温で1相になる上部臨界溶解温度を持つ系では、一般的に混合熱は吸熱となります。
Sponsored Link
液液平衡の状態図
前回の共沸点を持つ場合の状態図では共沸点の状態図を確認しました。今回は液液平衡の状態図を見ていきます。

液液平衡の状態図
一定圧力のもと、2つの相の液相組成の温度による変化を表した状態図は以下のようになります。
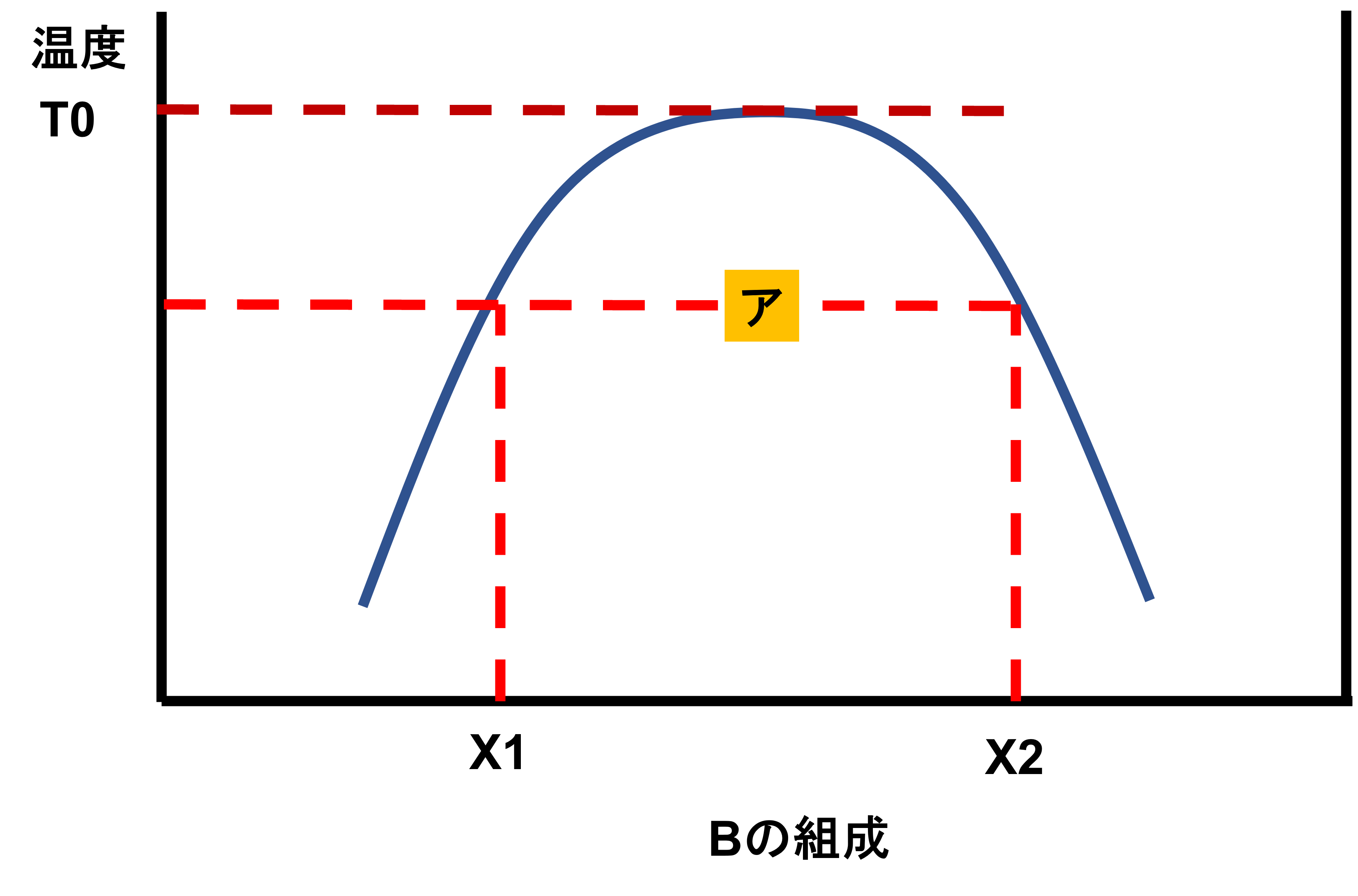
- T0;上部臨界溶解温度
成分Aより成分Bの方が比重が大きい時、「ア」のような曲線の内側では2相に分離しています。イメージとしては以下の図のような感じで、わかれていてもAもBも少しずつは存在しているような感じです。この時上層中のBの組成はX1、下層中のBの組成はX2となります。
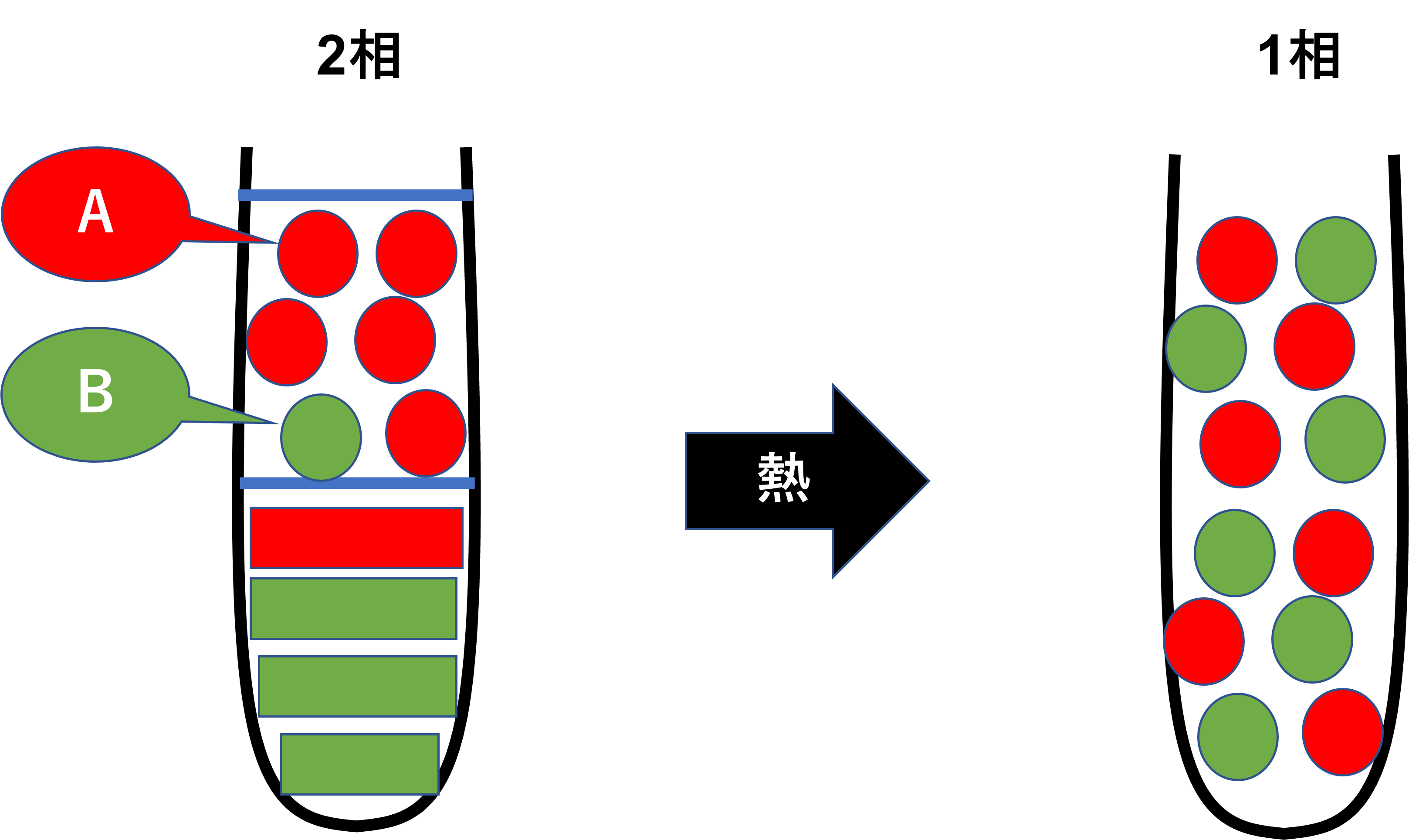
さらに温度を上げていき曲線より外側になると、均一な1相となります。
液液平衡の状態図はこれ以外にももちろんあり、成分の組み合わせによって下にとんがったグラフであったり、丸い円に覆われているグラフであったりと様々なグラフを描きます。一応これがスタンダードな形でありよほどでなければ、この形が問題として出されます。
それでは、いつものように国試風の例題を見てみましょう。
Sponsored Link
Sponsored Link
例題
成分Aと成分Bの二成分系の液液平衡についての状態図を以下に示した。次の問いに答えよ。
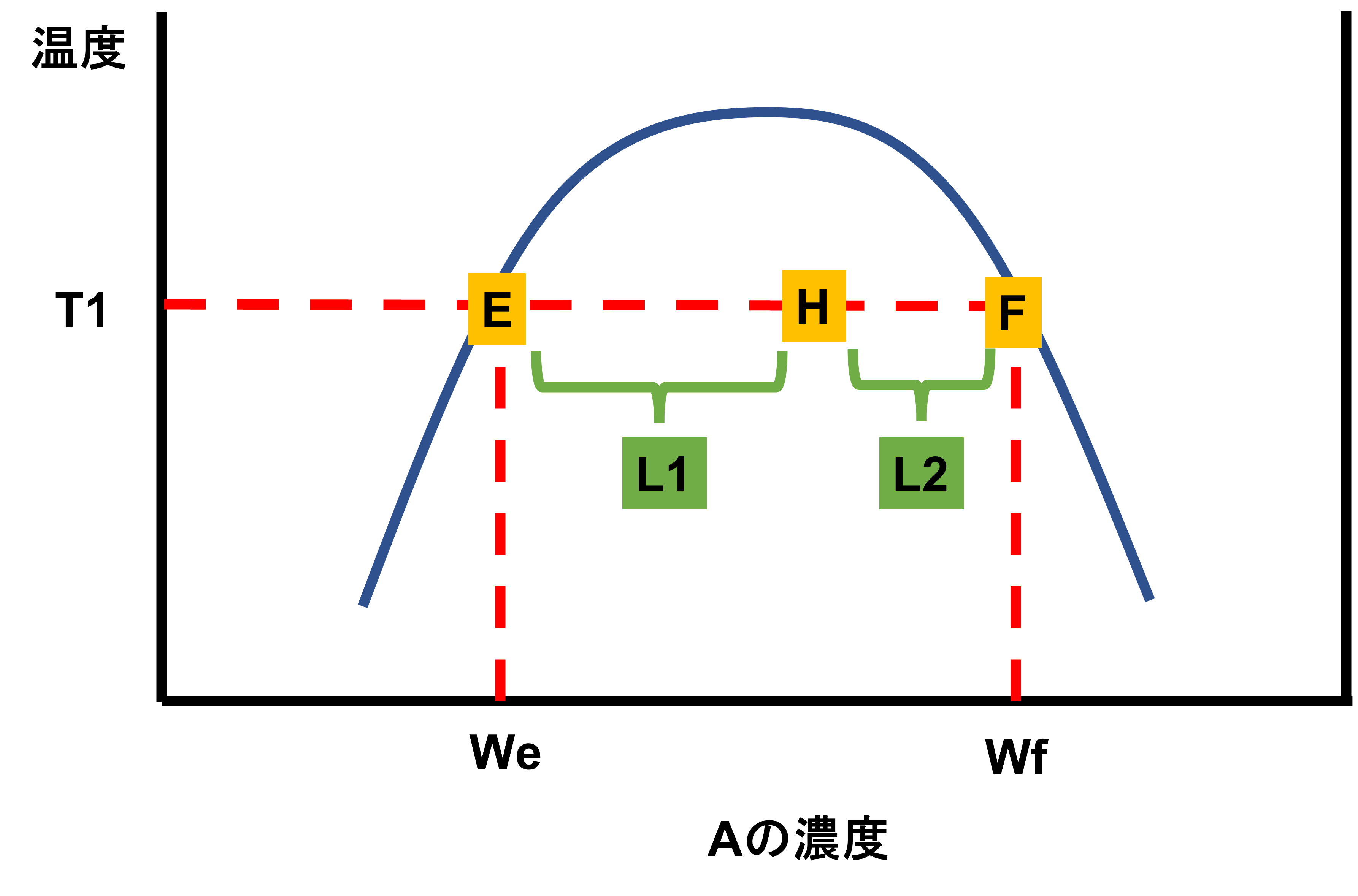
- 高温で1相になる計では、一般的に混合熱は発熱である。
- Wfは温度T1における成分Aの飽和溶解度である
- 点Hでは点Eと点Fの組成の2相に分離する。その重量比We/Wfは、L2/L1である。
高温で1相になる計では、一般的に混合熱は発熱である。
×。高温で1相になる上部臨界溶解温度を持つ系では、一般的に混合熱は吸熱となります。前回の気液平衡と混同しやすいので注意が必要です。
Wfは温度T1における成分Aの飽和溶解度である
×。Wfは温度T1における成分Bの飽和溶解度を表しています。横軸が成分A濃度であるため、右に行くにつれてAが濃くなり逆に左に行くにつれてAが薄まってきます。よってWeが成分Aがギリギリ存在しうる点であると言えます。
点Hでは点Eと点Fの組成の2相に分離する。その重量比We/Wfは、L2/L1である。
〇。上層Weと下層Wfの重量比は、We:Wf=L2:L1が成り立ちます。これは気液平衡と同じ考え方で問題ありません。
まとめ
- 液液平衡の状態図において、曲線の内側だと2相、曲線の外側だと1相になる。
- 液液平衡の状態図において、高温で1相になる上部臨界溶解温度を持つ系では、一般的に混合熱は吸熱となる。
- 液液平衡の状態図において、横軸に注目してどちらの飽和溶解度であるかを適切に判断しなくてはならない。
