

Sponsored Link
キラルとアキラル、光学活性と不斉炭素の関係
前回のRS配置、優先順位のつけ方ではRS配置について見てきました。今回はキラルとアキラルについて見ていきます。

ここらへんの語句は数がたくさんあり、お腹いっぱいかと思いますが、1つ1つしっかり抑えていきましょう。まずキラル、アキラルに関連する語句として光学活性の確認です。
光学活性
平面偏光と呼ばれる平らな光を物質に通した時に、その光が回転することがあり、これを光学活性と呼びます。
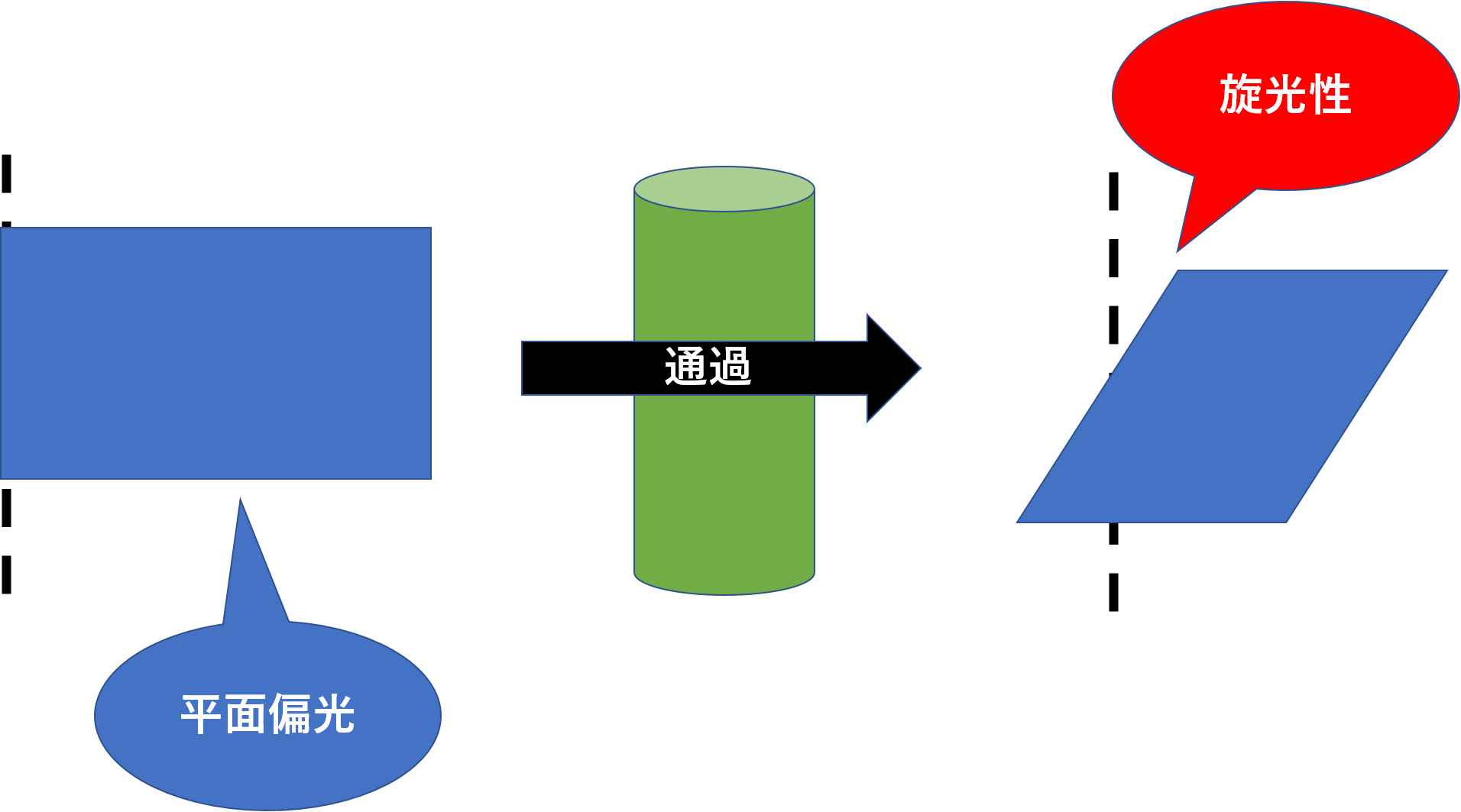
光学活性は右(時計回り)に回転させるものを右旋性と呼び、旋光度を+、化合物の名称の前にdをつけて表します。逆に左(反時計回り)に回転させるものを左旋性と呼び、旋光度を−、化合物の名称の前にl(エル)をつけて表します。
これもややこしくて覚えられない人は、左旋性をしっかり覚えましょう。左(left)のlを強引にひもづけましょう。lを覚えたら、同じ棒つながりで旋光度−をひもづけましょう。これだけしっかり覚えれば、消去法で右旋性を覚えられます。
ではキラルとアキラルを次に見ていきましょう
Sponsored Link
Sponsored Link
キラル
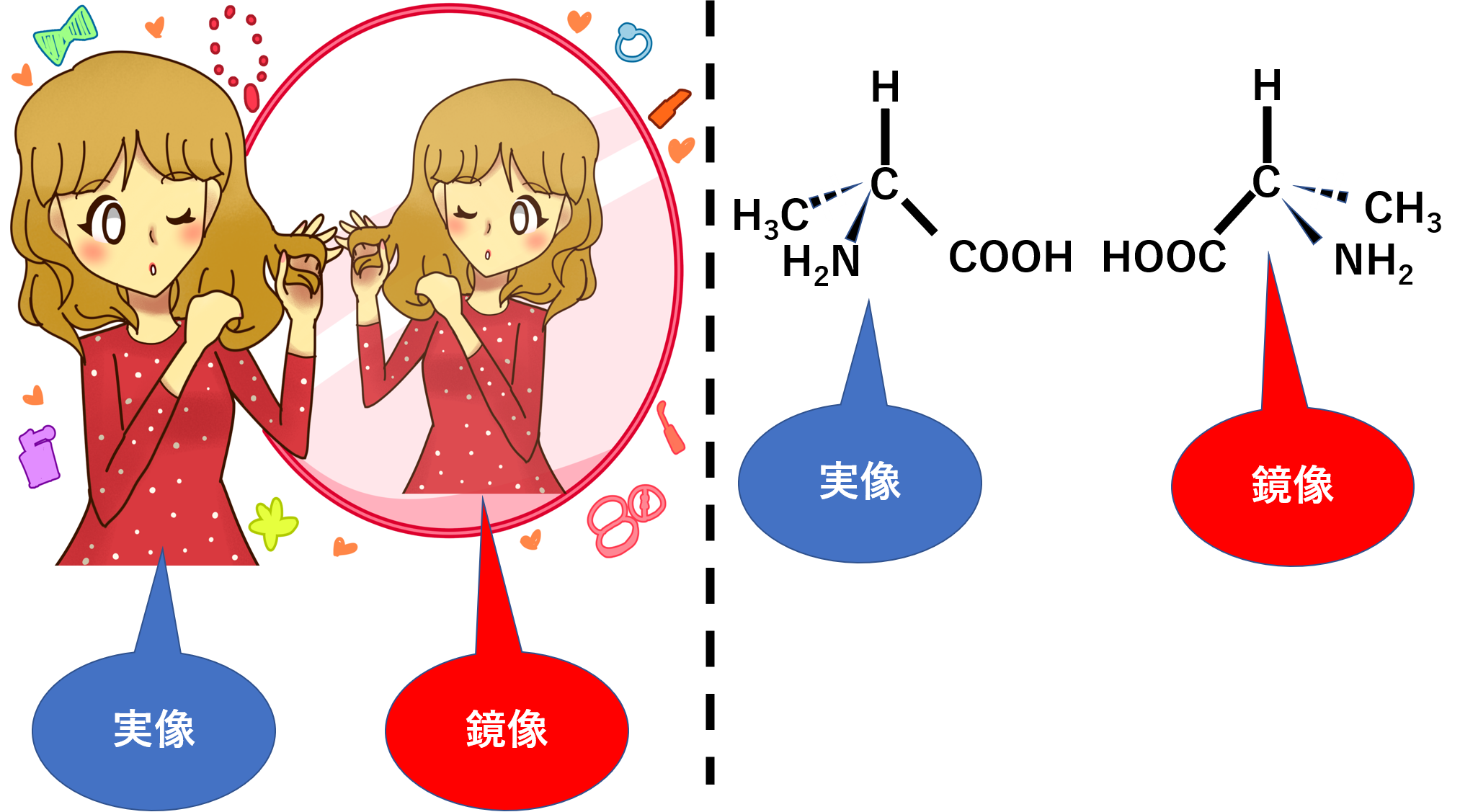
分子内に対称面を持たず、その分子の鏡像に重ね合わせることのできない場合をキラルと言います。
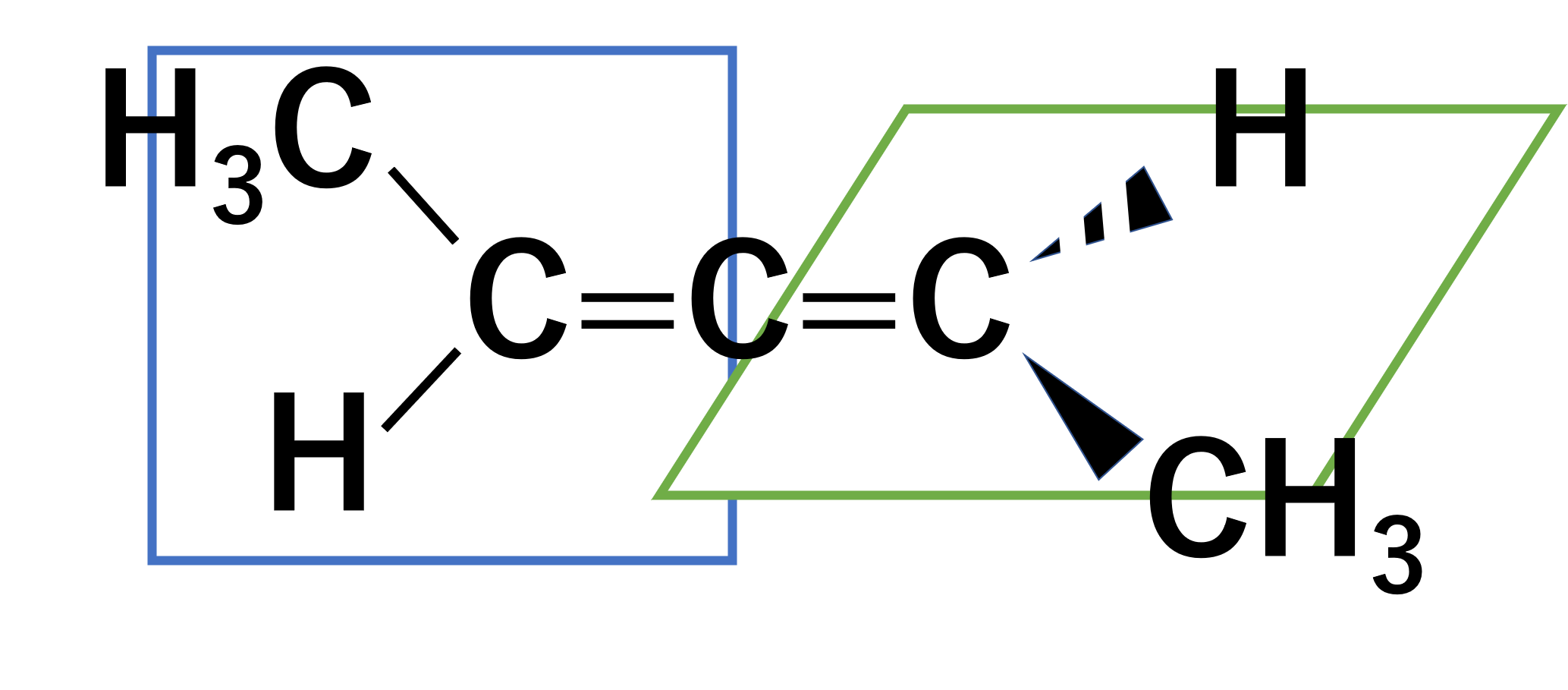
不斉炭素を持つ場合はキラルであることが多いです。例外として不斉炭素が無くてもキラルとなる場合があります。それはアレン誘導体などの回転ができないようなものの場合です。
単一のキラルな化合物は光学活性です。
アキラル
分子内に対称面をもち、その分子の鏡像と重ね合わせることができる場合をアキラルと言います。不斉炭素があるけれども、分子内対称面を持つものをメソ体と言いますが、メソ体はアキラルです。
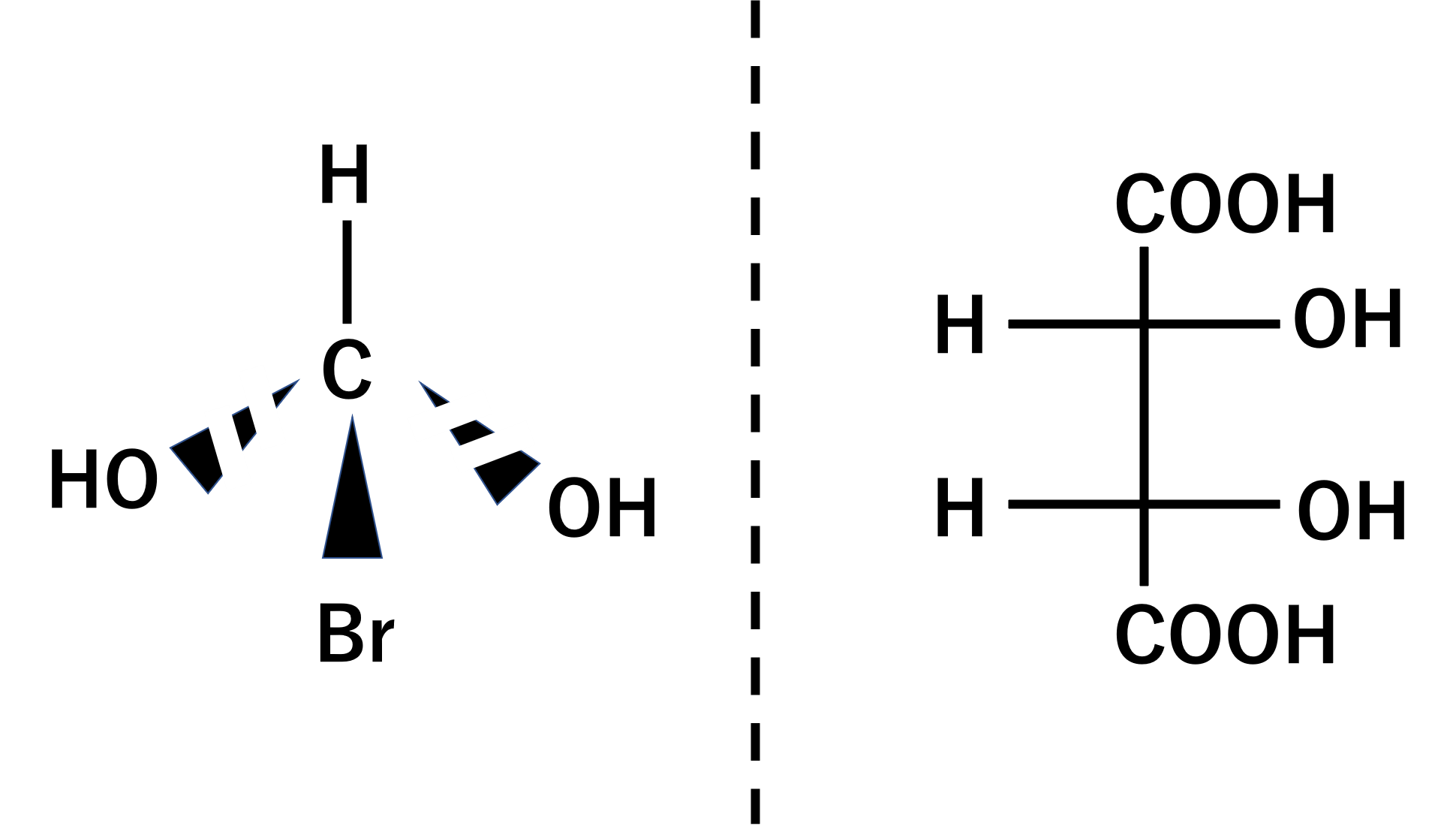
アキラルな分子は光学不活性となります。
ややこしいのでまとめるとキラル、アキラル、不斉炭素の関係性は以下の図のようにあらわすことができます。

国試風の例題を見てみましょう。
例題1
次の化合物に関して以下の問いに答えよ。
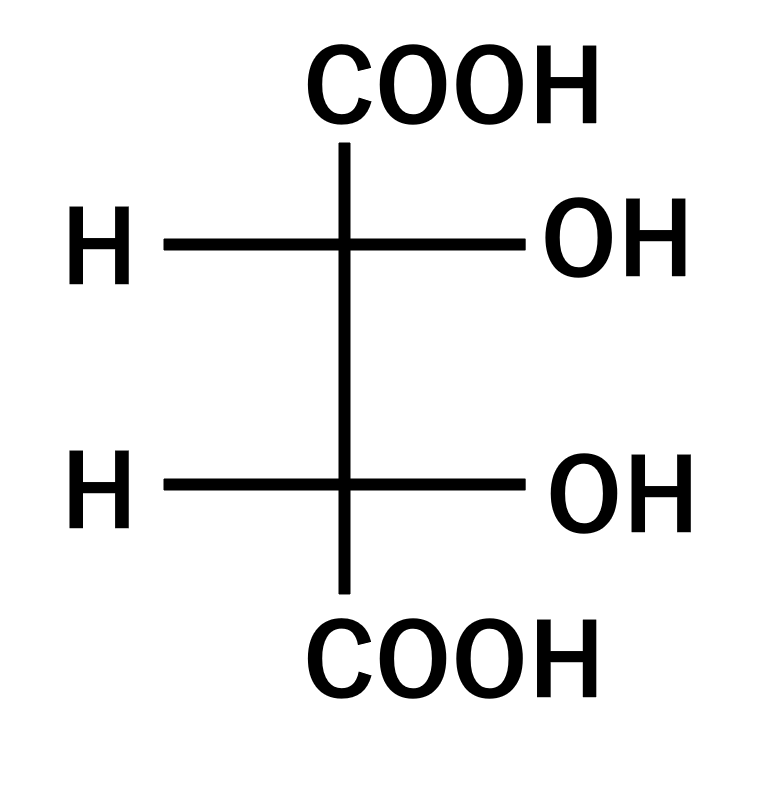
- 1、この化合物はキラル、アキラルどちらか?
- 2、この化合物は不斉炭素を何個持つか?
1、この化合物はキラル、アキラルどちらか?
分子内対称面があり、この化合物はメソ体です。メソ体はアキラルなので、アキラルが答えです。

2、この化合物は不斉炭素を何個持つか?
この化合物の炭素をみてみると、全て違う置換基がついているので、不斉炭素は2個となり、これが答えです。
まとめ
- 光学活性は右(時計回り)に回転させるものを右旋性と呼び、旋光度を+、化合物の名称の前にdをつけて表す。
- 左(反時計回り)に回転させるものを左旋性と呼び、旋光度を−、化合物の名称の前にl(エル)をつけて表す。
- 分子内に対称面を持たず、その分子の鏡像に重ね合わせることのできない場合をキラルと言う。
- 分子内に対称面をもち、その分子の鏡像と重ね合わせることができる場合をアキラルと言う。
