

Sponsored Link
sp3混成軌道、sp2混成軌道、sp混成軌道の考え方
前回のイオン結合、金属結合、共有結合(σ結合、π結合)では、σ結合やπ結合などについてみてきました。これらは、s軌道やp軌道により作られる話をしましたが、ものによってはs軌道やp軌道だけでは説明がつかないことがあります。そういった時に出てくるのが混成軌道となり、今回はそれを見ていきます。
混成軌道には大きく3つの種類があります。
- sp3混成軌道
- sp2混成軌道
- sp混成軌道
Sponsored Link
Sponsored Link
sp3混成軌道
まず軌道の復習となります。炭素は周期表で6番目であるため、電子を6個持ちますが、これはどのように軌道に入るでしょうか?
前回の時に割愛しましたが、これを正しく理解するにはスピンを知っておく必要があります。電子は自転していて磁力を発生しています。軌道ではこれを矢印で表します。
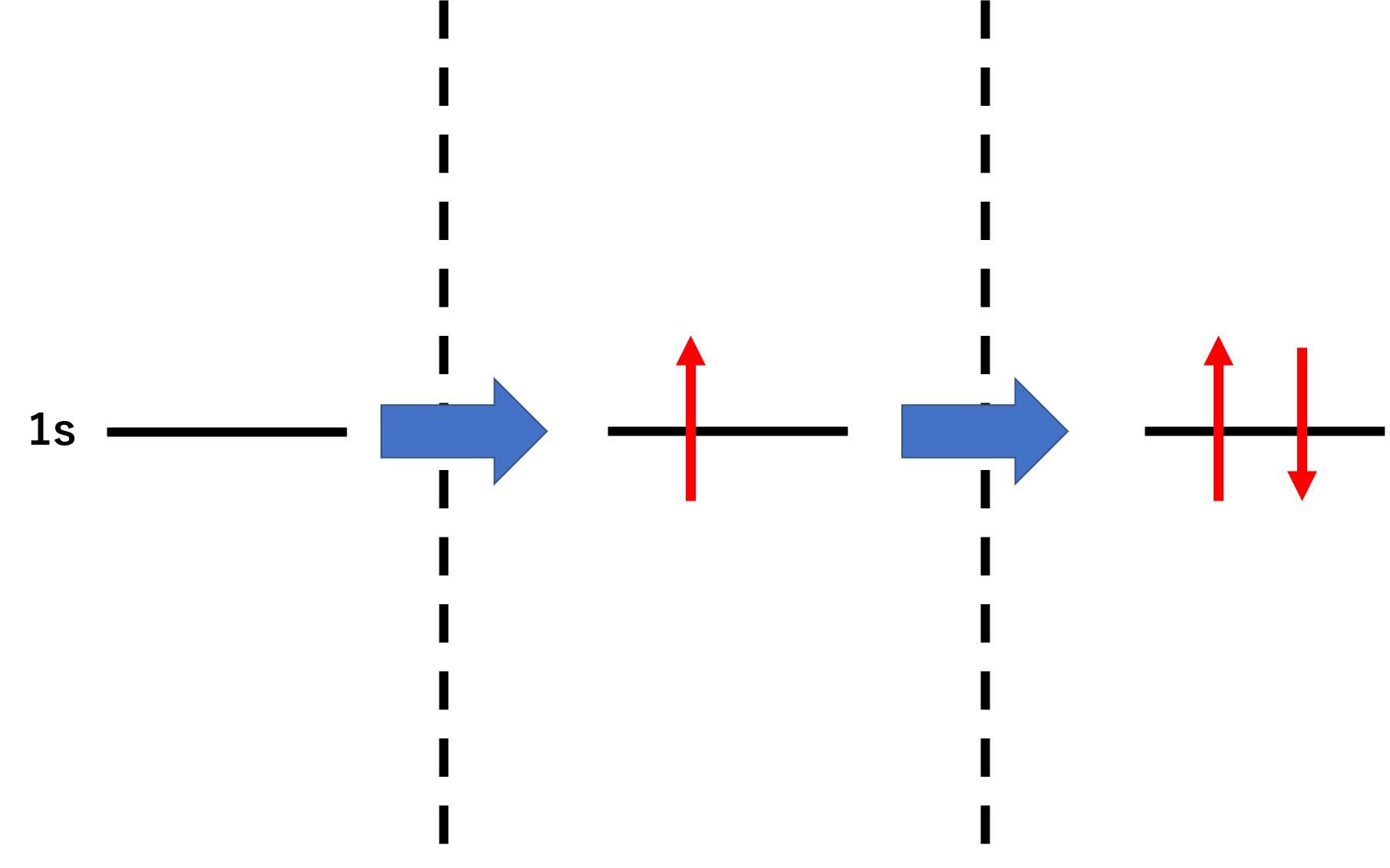
さて、話を炭素に戻すとエネルギーの低い順番に入っていくので、1s軌道に2個入ります。この時に磁力を打ち消すように、互いが逆になって電子が入ります。次に2s軌道に2個入ります。これも1sと同じように互いが逆になって電子が入ります。
最後に2p軌道に入っていきますが、2p軌道はx軸、y軸、z軸の3つあり、いきなり1つのところ(例えば2px)に電子は2個入りません。1つの軌道に1個ずつ埋められていきます。例えば今回の場合は2pxに1個、2pyに1個というようになります。
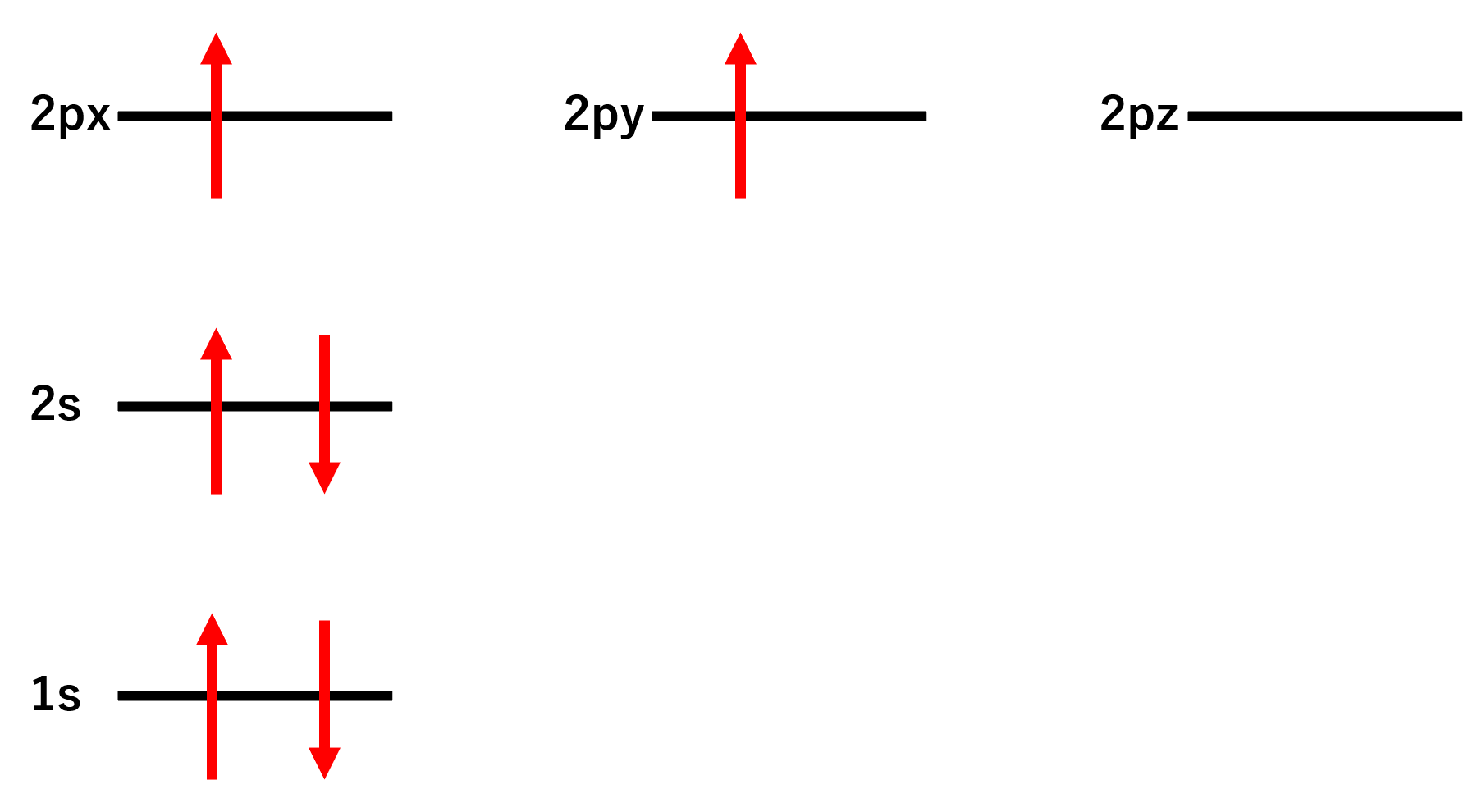
ここでスピンを良く見てみると、2pxと2pyが1個ずつ電子が埋まっていて握手をする手が2つしかないことがわかります。そこで、2s軌道の電子を2pzに分け与えると握手する手が4本に増えます。これが混成軌道の考え方です。sp3混成軌道はその名の通りs軌道1個とp軌道3つからできています。
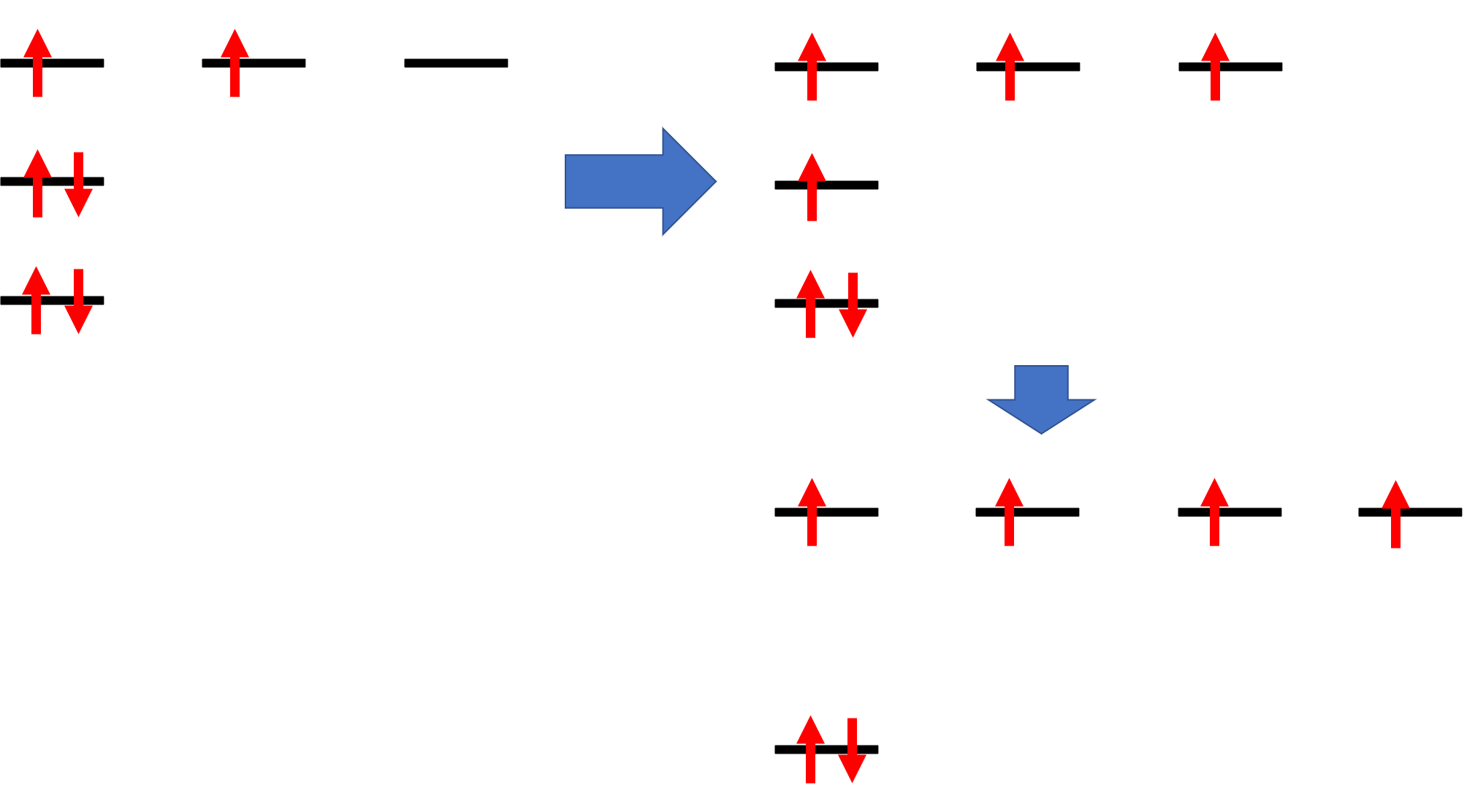
握手する腕が4本均等に出ているため、sp3混成軌道の結合角は一般的に109.5°となり、正四面体構造をとります。構造式を書くときに、角度にこだわる先生がいたかもしれませんが、これはこういう理由によります。sp3混成軌道はメタン(CH4)などを考えればわかりやすいですね。
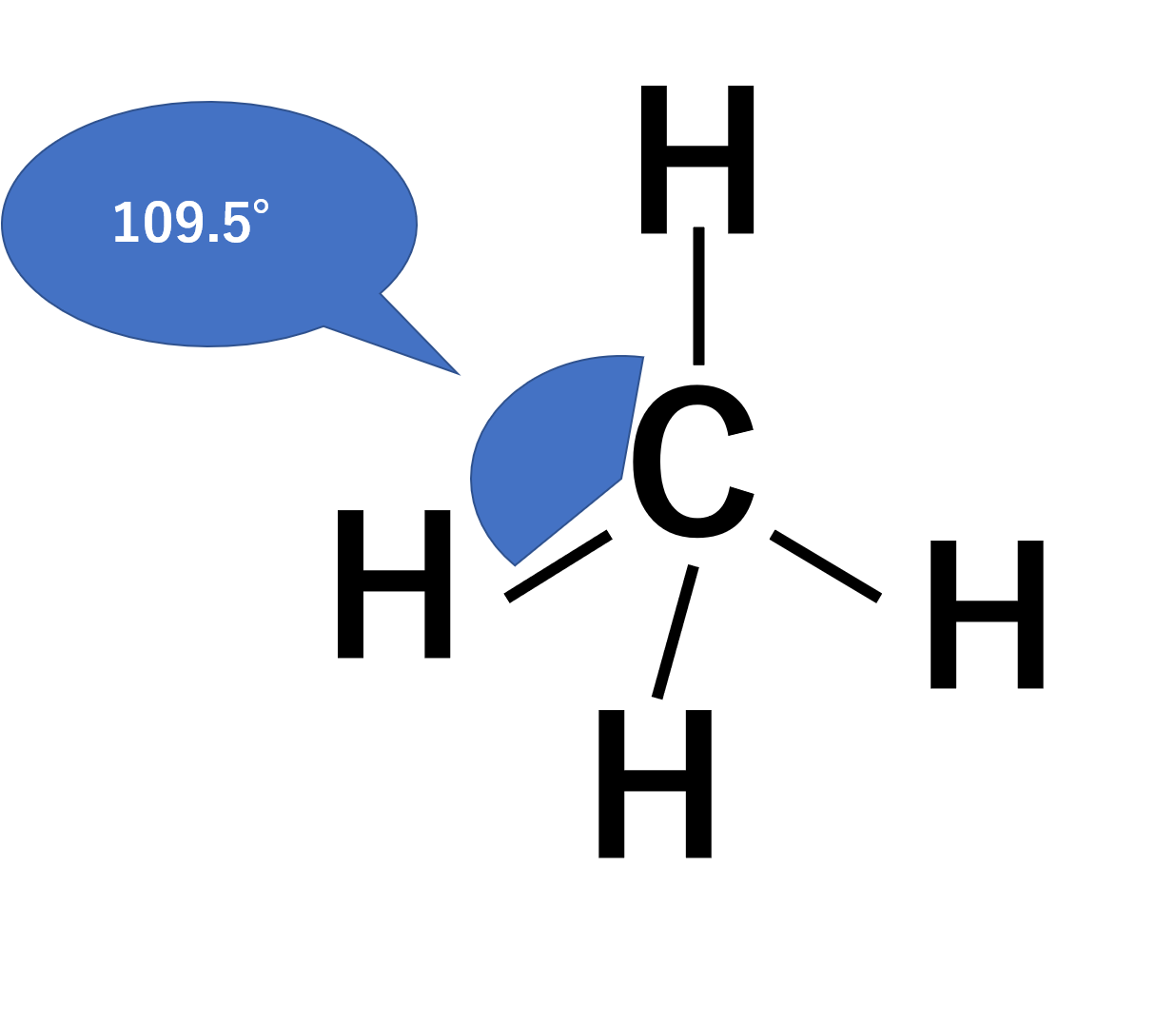
sp2混成軌道
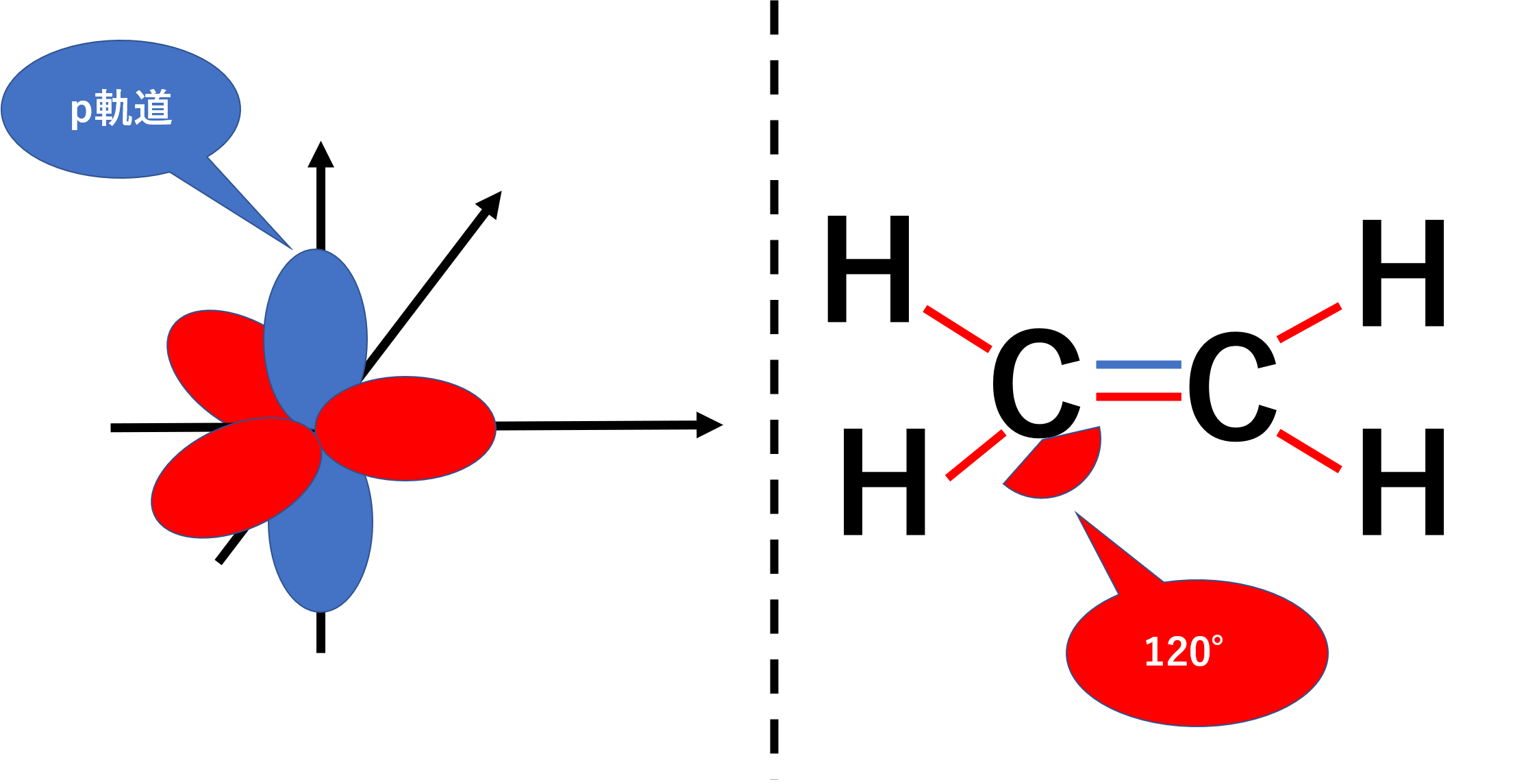
sp2混成軌道は、2s軌道1個と2p軌道2個からなります。残った2p軌道1個はどうなるかと言いますと二重結合、すなわちπ結合に関わります。
エチレン(H2C=CH2)などを代表するように、sp2混成軌道の結合角は一般的に120°となり平面構造をとります。
sp混成軌道
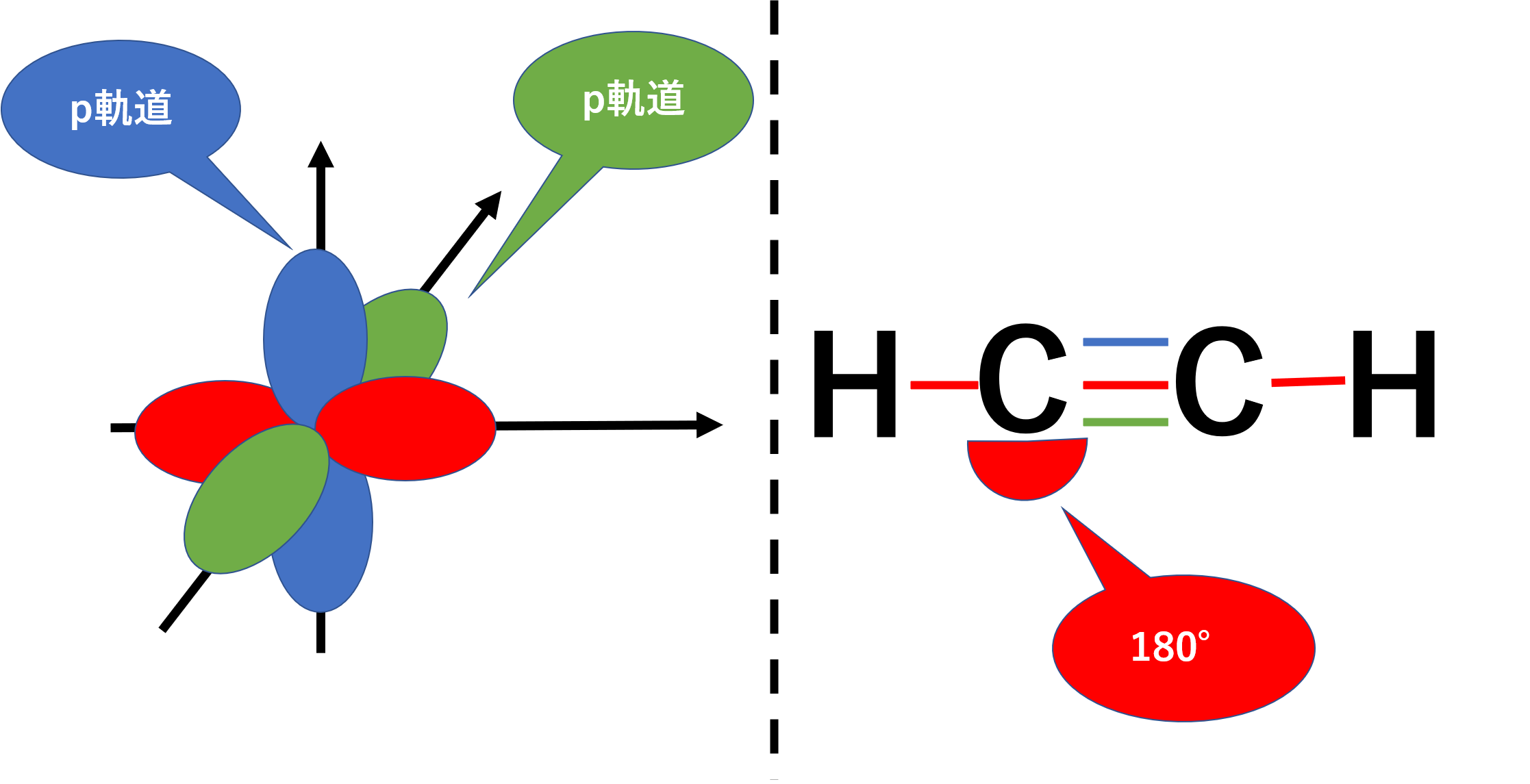
sp混成軌道は、2s軌道1個と2p軌道1個からなります。残った2p軌道2つは先ほどと同じようにπ結合に関わり三重結合を作ります。
アセチレン(H-C三C-H)などを代表するように、sp混成軌道の結合角は一般的に180°となり直線構造をとります。
まとめ
- 混成軌道を考える時にはスピンを理解する必要がある。
- sp3混成軌道、sp2混成軌道、sp混成軌道のそれぞれの結合角を理解することで正しい構造式を描ける。
