

Sponsored Link
共鳴構造の基本の考え方
前回のsp3混成軌道、sp2混成軌道、sp混成軌道例題編では例題を交えながら混成軌道を見ました。今回は混成軌道と同じくらい大事な共鳴についてみていきます。共鳴もできないとこれから先の反応機構などでつまづいてしまうためしっかり理解する必要があります。
共鳴
共鳴は結合や電荷がπ結合を介して分散することを言います。共有結合において電子は一か所にとどまるよりか、分散していた方がエネルギー的に安定します。このエネルギー的に安定という考え方が今後大事になってくる考え方で、それを成し遂げる1つの方法が共鳴となります。
共鳴は原子の位置は変わらず、あくまでも電子の位置が変わるだけなので注意が必要です。例えば、以下のようなものが共鳴構造となります。
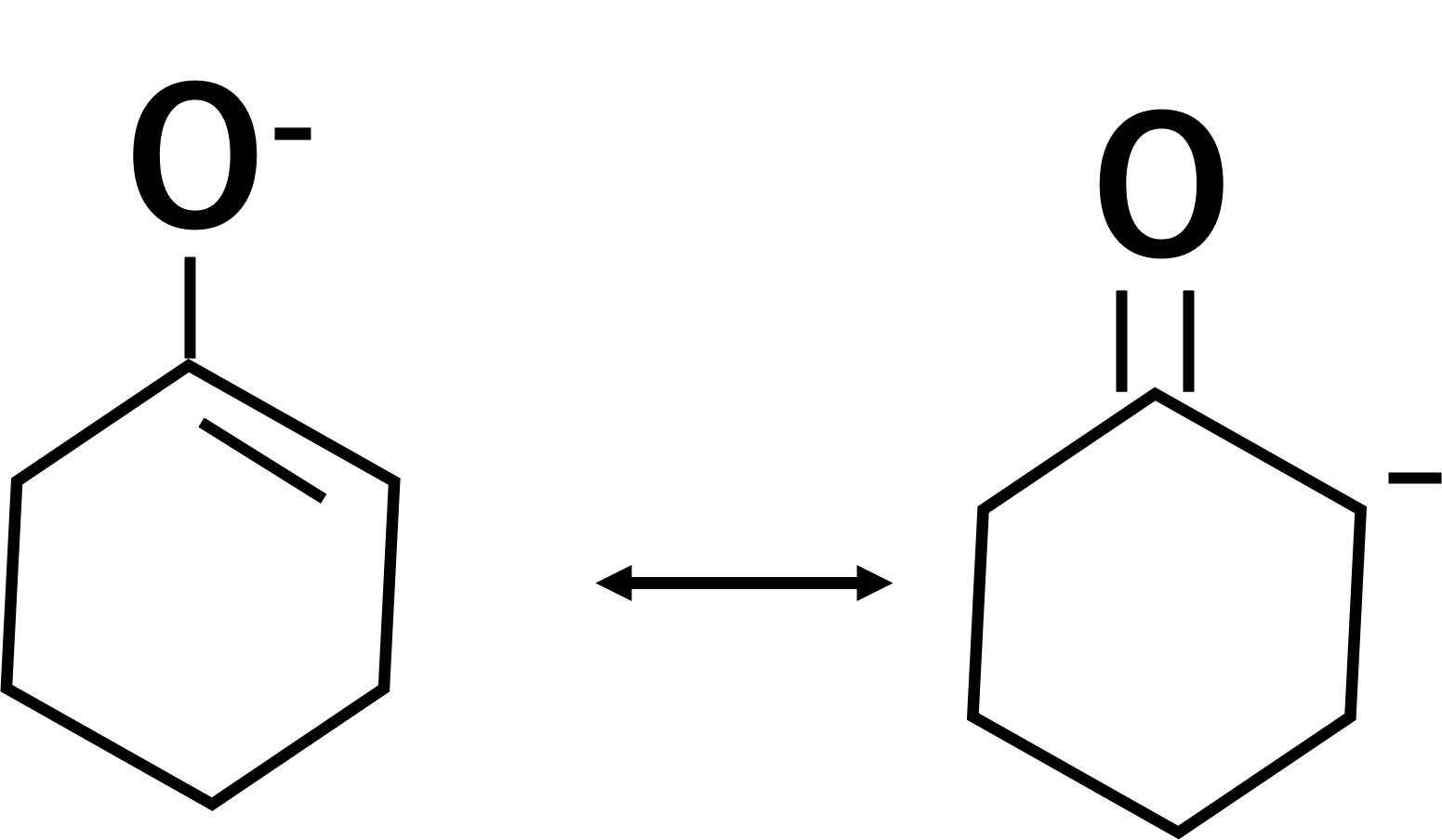
ここで共鳴のルールですが、共鳴の構造式を関連付ける時は両矢印で表します。
Sponsored Link
Sponsored Link
共鳴における電子の動き
先ほどの共鳴構造はどのようにして電子が動いたのでしょうか?
ここでも共鳴というか、電子の動きに関するルールです。電子1個の移動の時は方刃矢印で表します。電子2個の移動の時は両刃矢印で表します。共鳴ではよほどのことが無い限り電子2個の移動となるので、両刃矢印を使います。
まず酸素原子にある、2個の電子が単結合のところに行き、二重結合を作ります。そうすると、もとにあったところの炭素は二重結合が2つになってしまうため、二重結合の電子が炭素原子に入り炭素原子がマイナスとなります。
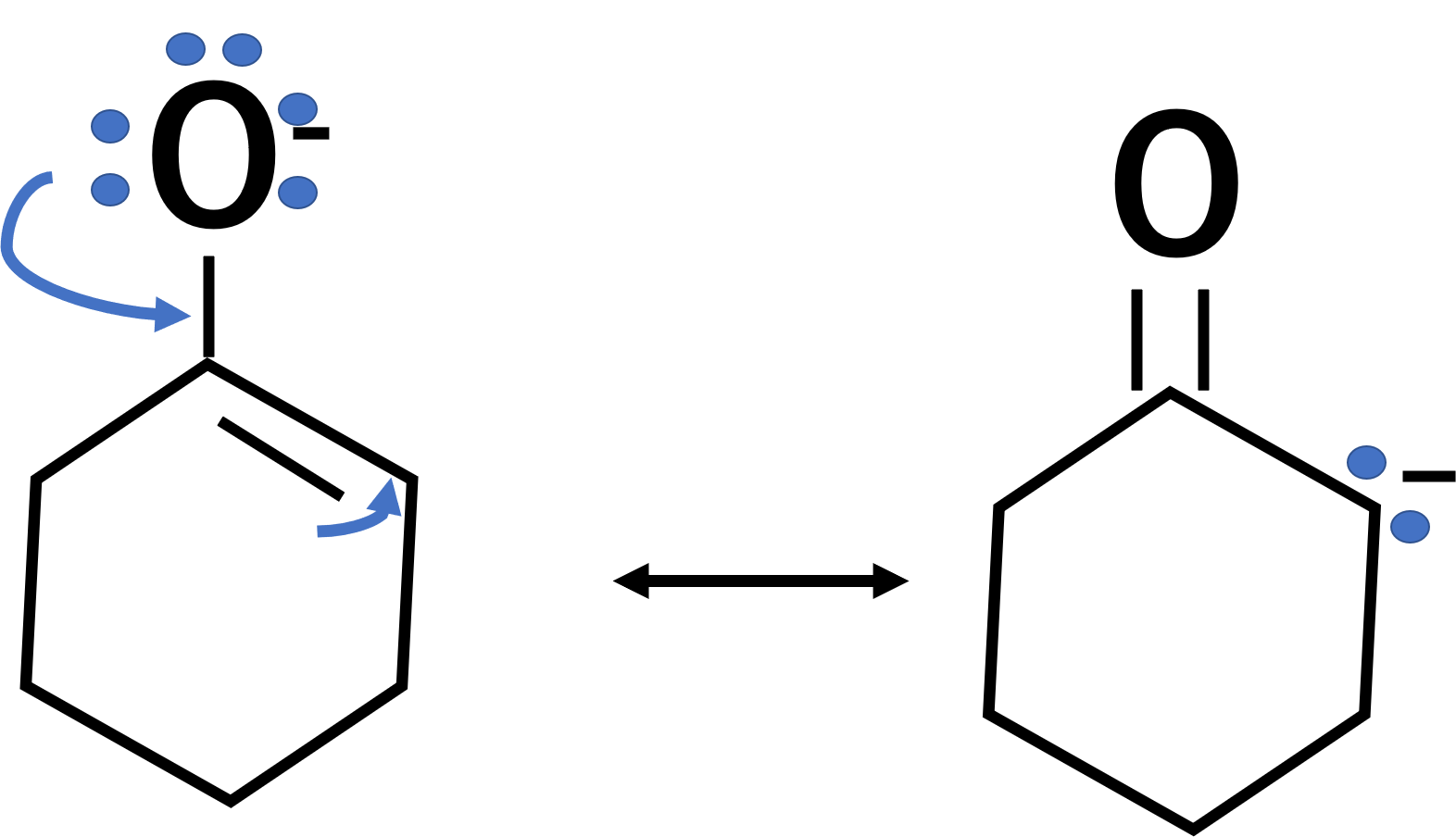
共鳴構造を考える上で、この動きは基本の形です。この二重結合、単結合、マイナスという形を叩き込んでおきましょう。
では例題を見ていきましょう
例題
次の化合物の共鳴構造を全てかけ
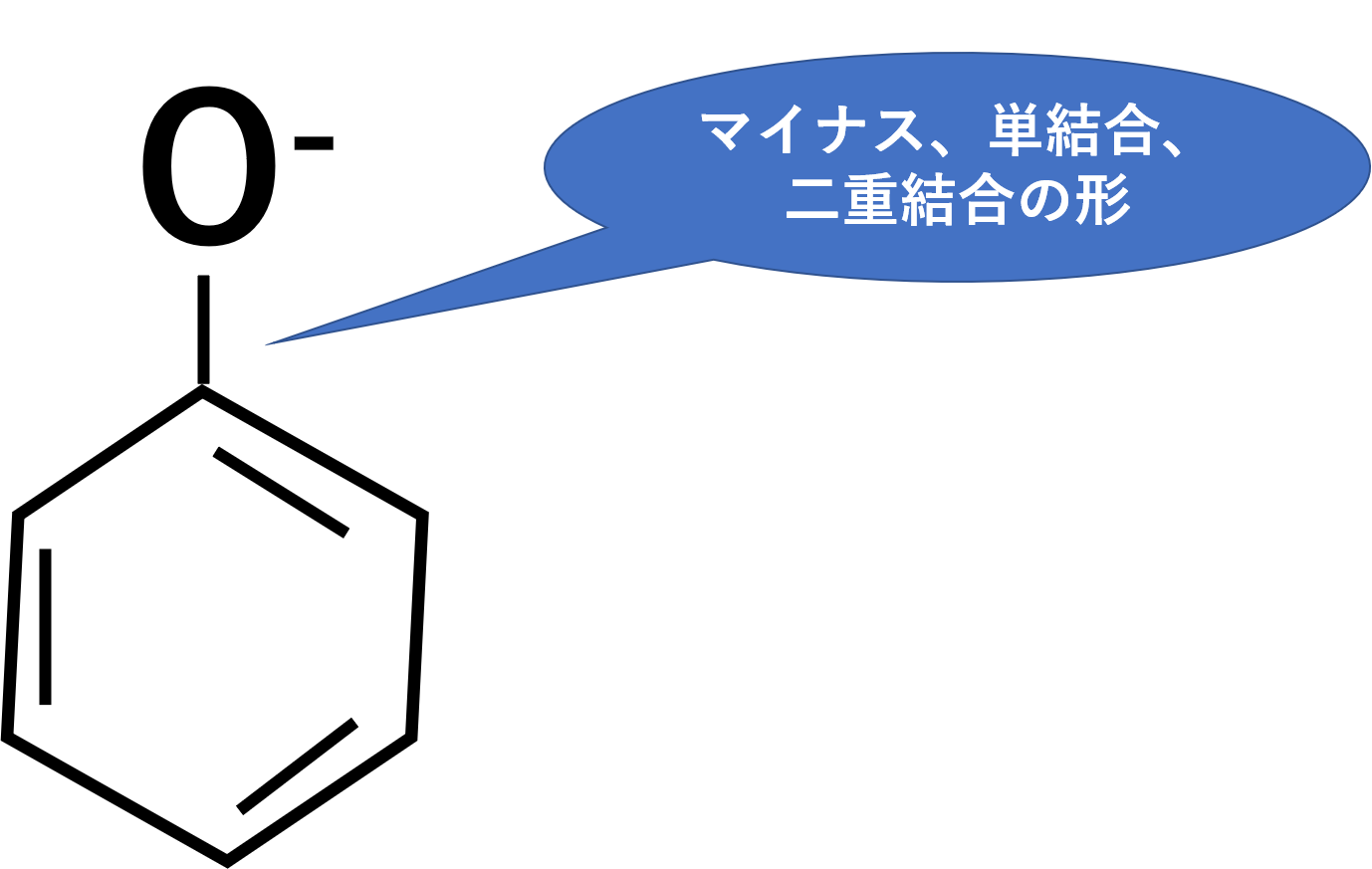
構造式を見ると、酸素原子がマイナス、単結合、二重結合という先ほどと同じ構造をとっています。そのため電子は動くことができ、以下のような形になります。
さらにできたものを良く見ると、同じようにマイナス、単結合、二重結合の形が見えます。そのため電子はさらに動くことができます。
できた構造式をさらにみると、またマイナス、単結合、二重結合の形が見え、電子は動くことができます。
最終的に共鳴構造として以下のものを書くことができます。これが答えです。
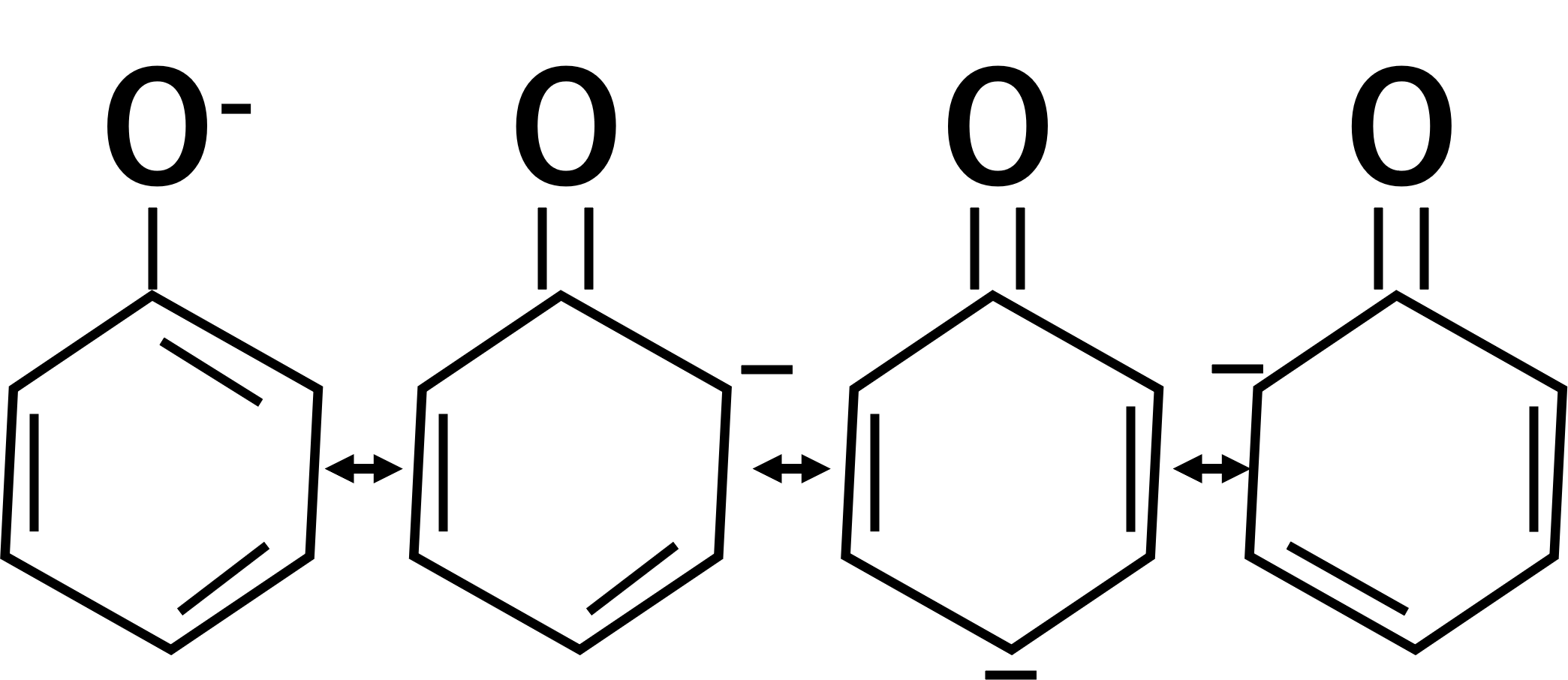
共鳴が苦手な人は、マイナス、単結合、二重結合の形を探しましょう。
まとめ
- 共鳴をとることで電子が分散しエネルギー的に安定する。
- 共鳴の構造式を関連付ける時は両矢印を用いる。
- 共鳴構造を考える上で、二重結合、単結合、マイナスの形が基本。
