

Sponsored Link
s軌道、p軌道、d軌道とエネルギー準位
前回のLewis構造式、電子殻と価電子ではLewis構造式や電子殻を確認しました。今回は電子の軌道について見ていきます。

電子の軌道
前回電子は原子の周りにいるという話をして、冒頭のような図を用いましたが、これは高校までのイメージとなります。実際はある空間に電子は存在していてそれを軌道と呼びます。
軌道には、s軌道、p軌道、d軌道、f軌道などの種類があり、それぞれの数があります。例えばd軌道までは以下のような形をとります。
- s軌道;軌道の数1個
- p軌道;軌道の数3個
- d軌道;軌道の数5個
Sponsored Link
Sponsored Link
いまいちよくわからないと思うので、次は形を見てみてください。軌道の形は以下のようになっていて、xyzの軸にそって描かれます。
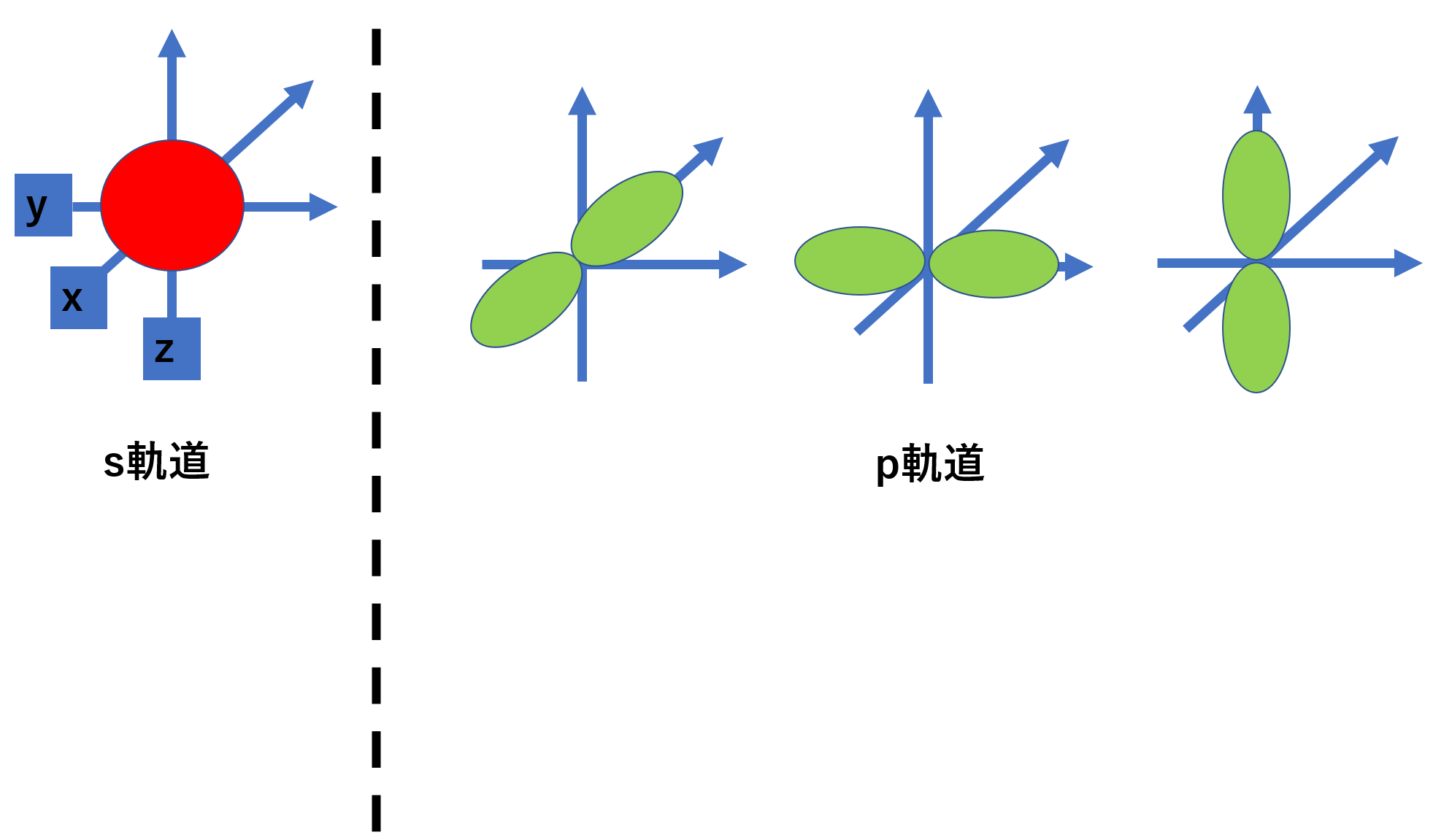
s軌道は球形なので1つしか描けませんが、p軌道は亜鈴形であるため、x軸に伸びる形、y軸に伸びる形、z軸に伸びる形と3つ軌道を描くことができます。そのため気道の数は3つとなります。
軌道のエネルギー準位
これらの軌道の中に電子が存在するわけですが、前回にも原子核に近い内側ほどエネルギーが低くそこから電子が入っていくという話をしましたが、軌道も同じく、エネルギー準位が低いものから埋められていきます。
例えば、前回K殻は2個、L殻は8個、M殻は18個・・・・の最大収容数を持ちます。つまり
- K殻;2個→1s軌道に2個
- L殻;8個→2s軌道に2個、2p軌道に6個
- M殻;18個→3s軌道に2個、3p軌道に6個、3d軌道に10個
ということになります。これらの軌道のエネルギー準位は、以下の図のようになっています。

1s軌道は一番低く、次に2s軌道、さらに2p軌道・・・と続きます。しかしよく見てみると、3d軌道と4s軌道がいい戦いをしていて、ほぼ同じくらいのエネルギー準位となっています。これを簡単に覚えるにはさらに以下の図が有効です。
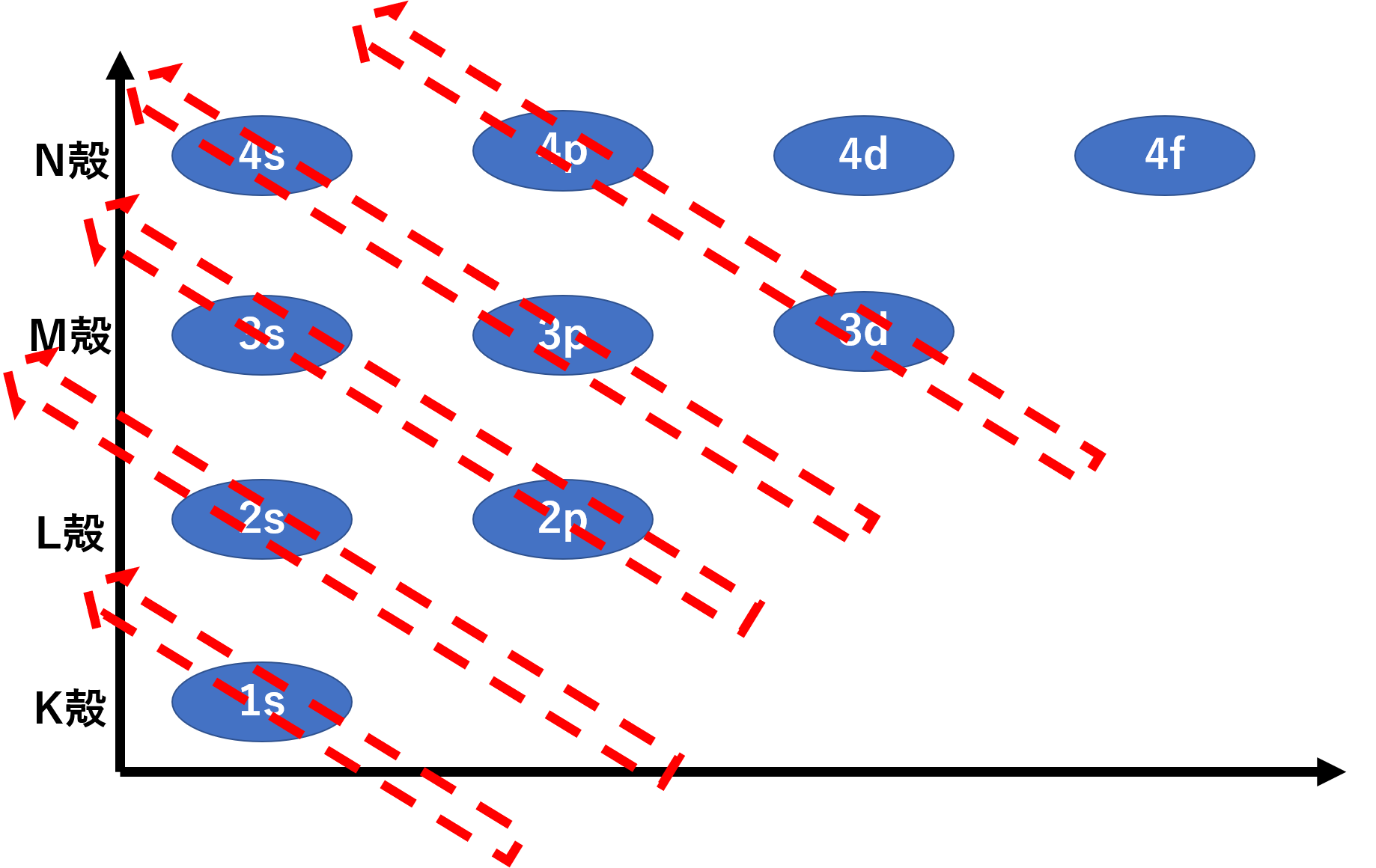
下から軌道を並べて、右斜め下から、左斜め上に向かって見ていきます。この順番に電子が軌道に埋められていきます。その結果1s軌道→2s軌道→2p軌道→3s軌道→3p軌道→4s軌道→3d軌道・・・・・となります。
軌道は結合を考える時にも重要となってくるので、しっかり押さえておきましょう。
まとめ
- 電子の軌道は、s軌道、p軌道、d軌道などの種類があり、それぞれ形がある。
- 1s軌道→2s軌道→2p軌道→3s軌道→3p軌道→4s軌道→3d軌道・・・・・というようにエネルギー準位が低い軌道から順番に電子は埋められていく。
