

Sponsored Link
芳香族の反応1、求電子置換反応、ニトロ化、スルホン化、ハロゲン化
前回のアルキンの反応2、Lindlar(リンドラー)触媒による接触水素化とBirch(バーチ)還元では、アルキンの水素化についてみてきました。今回は芳香族の置換反応について見ていきたいと思います。

芳香族と言えば、なんと言ってもベンゼン!!ベンゼンを書けば書くほど、しょぼんとした顔に見えてしまいます。なんとも言えない顔で癒されます。これは誰もが通る道だと思います。私の大学にはベンゼンに足を生やしたベンゼン君?が至る所に落書きされていたのを思い出します(笑)皆さんの大学にもベンゼン君はいるでしょうか?
では本題に戻ります(笑)
Sponsored Link
Sponsored Link
芳香族の求電子置換反応
今回の反応に関わる+NO2、SO3、FeBr3など陽イオンや空軌道を持つものが電子不足です。そのため電子を求めています。このようなものを求電子試薬と呼びます。求電子試薬は電子を求めているため、電子が豊富な二重結合などと反応が起こりやすいです。
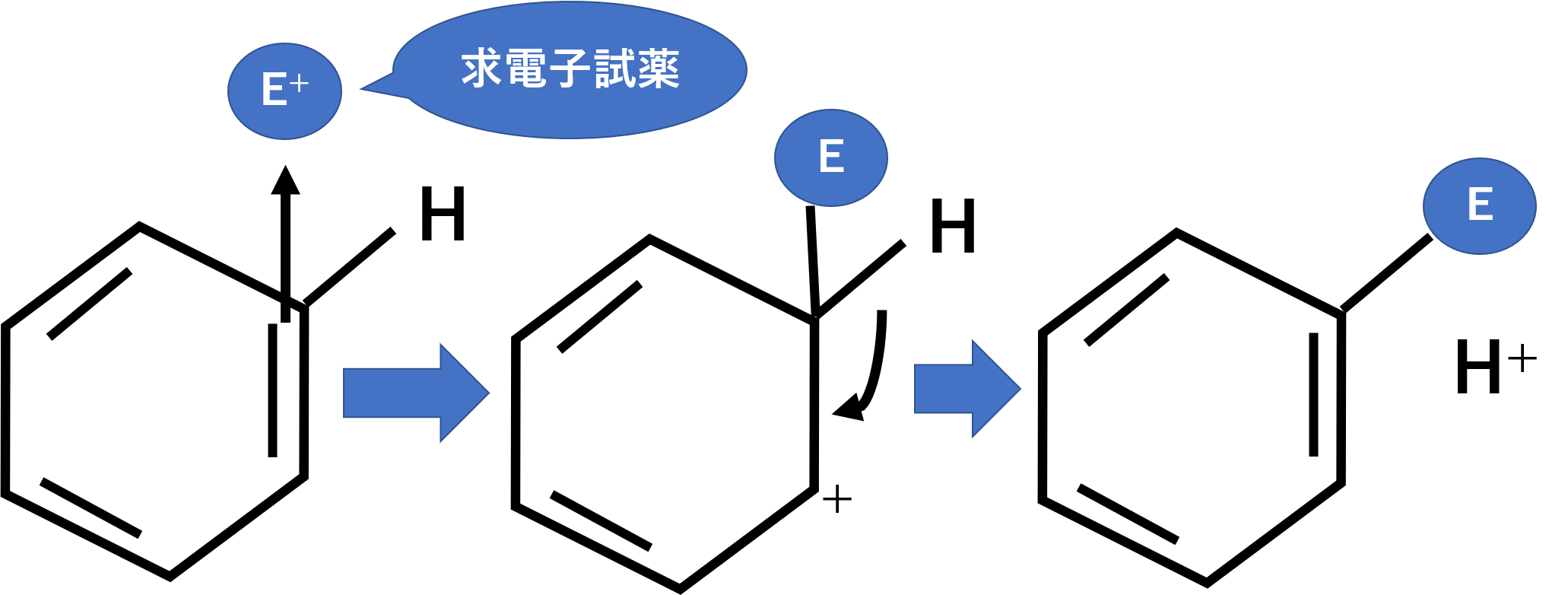
そしてベンゼン環を代表とする芳香族は、sp2混成軌道で作られており、π電子が共鳴により非局在化しています。今回の求電子置換反応は、ベンゼンのπ結合が求電子試薬を攻撃して付加します。次に水素が離脱し、全体でみると求電子試薬が水素に置き換わる形(置換反応)で行われています。
では、このイメージをもって芳香族の求電子置換反応であるニトロ化、スルホン化、ハロゲン化を見ていきましょう。
ニトロ化
ベンゼンに、濃硝酸-濃硫酸混液を反応させるとニトロ化が起こり、ニトロベンゼンができます。先ほどの説明のように、+NO2(ニトロニウムイオン)が求電子試薬として働き求電子置換反応が起こります。

スルホン化
ベンゼンに発煙硫酸を反応させるとスルホン化が起こり、ベンゼンスルホン酸ができます。こちらはSO3(三酸化硫黄)が求電子試薬として働き求電子置換反応が起こります。
ハロゲン化
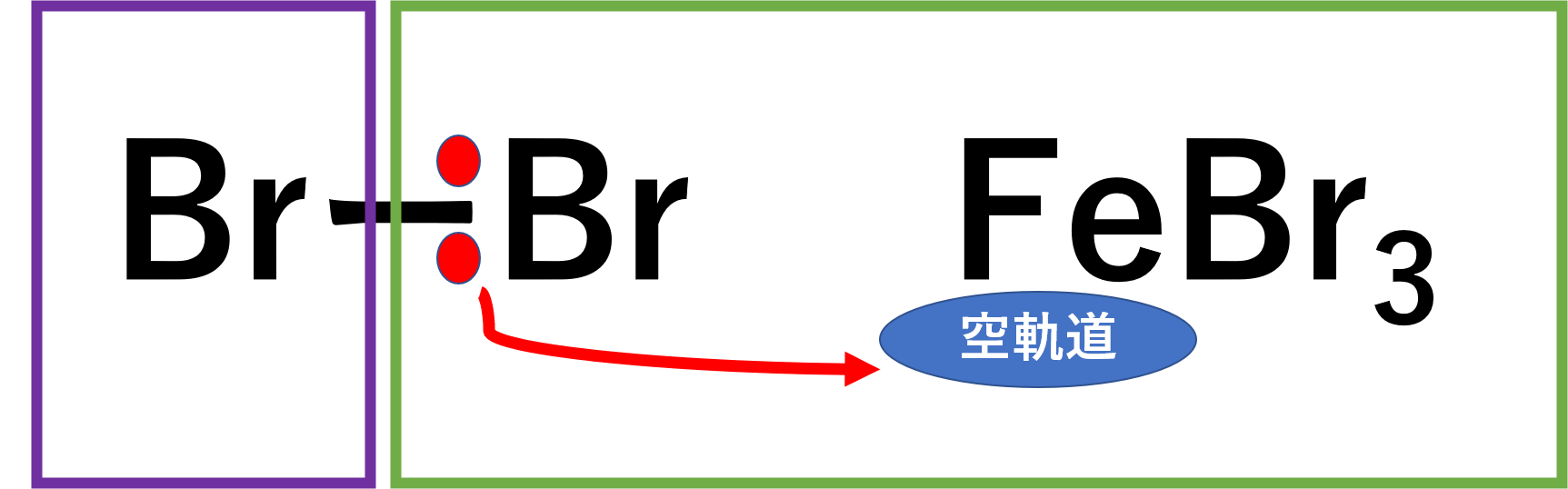
ベンゼンにFeCl3存在下で塩素、FeBr3存在下で臭素を反応させるとハロゲン化が起こり、クロロベンゼン、ブロモベンゼンができます。
この反応はFeの空軌道にBr2の片方の電子を受け取ることでBr+を作り求電子試薬として働くことで、求電子置換反応が起こります。
まとめ
- ベンゼン環はsp2混成軌道でできていて、π電子が共鳴により非局在化している。
- 陽イオンや空軌道などがあり電子不足のものを求電子試薬と呼ぶ。
- 芳香族の求電子置換反応は、求電子試薬が付加して、その後水素が離脱する反応が起こる。
