

Sponsored Link
sp3混成軌道、sp2混成軌道、sp混成軌道例題編
前回のsp3混成軌道、sp2混成軌道、sp混成軌道の考え方では混成軌道の基本について見ました。今回は応用編もかねてsp3混成軌道、sp2混成軌道、sp混成軌道の例題を見ていきたいと思います。
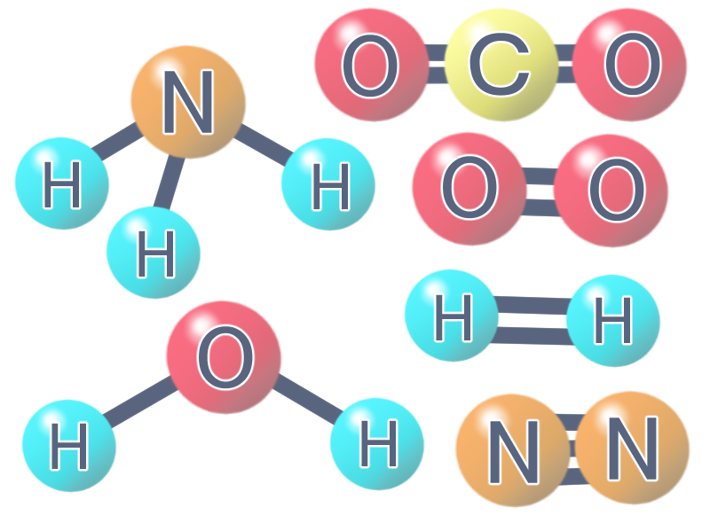
早速例題を見ていきましょう。
例題1
1、メチルカチオンの炭素の混成軌道を答えよ。
2、メチルアニオンの炭素の混成軌道を答えよ。
1、メチルカチオンの混成軌道を答えよ。
まずメチルカチオンとはCH3+のことです。普通はメタンCH4のように炭素は電子を4つ持ち、4本の腕は全て握手しています。しかしCH3+電子が1個少なく3つしか持たずプラスに荷電しています。つまりメチルカチオンの腕は3本となり、sp2混成軌道となります。これが答えです。

2、メチルアニオンの混成軌道を答えよ。
メチルアニオンはCH3-のことです。メチルアニオンは通常の炭素より電子が1個多く、マイナスに荷電しています。つまり腕3本は水素と握手していますが、電子だけ入っている腕が存在するのでsp3混成軌道となります。これが答えです。

続いて応用編です。
Sponsored Link
Sponsored Link
例題2
1、三フッ化ホウ素のホウ素の混成軌道を答えよ。
2、アンモニアの窒素原子の混成軌道を答えよ。
3、プロパジエンの中央炭素の混成軌道を答えよ。
1、三フッ化ホウ素のホウ素の混成軌道を答えよ。
ホウ素は原子番号5であるため、周りに電子を3つ持ちます。これらがフッ素と握手をしているので、sp2混成軌道となります。これが答えです。
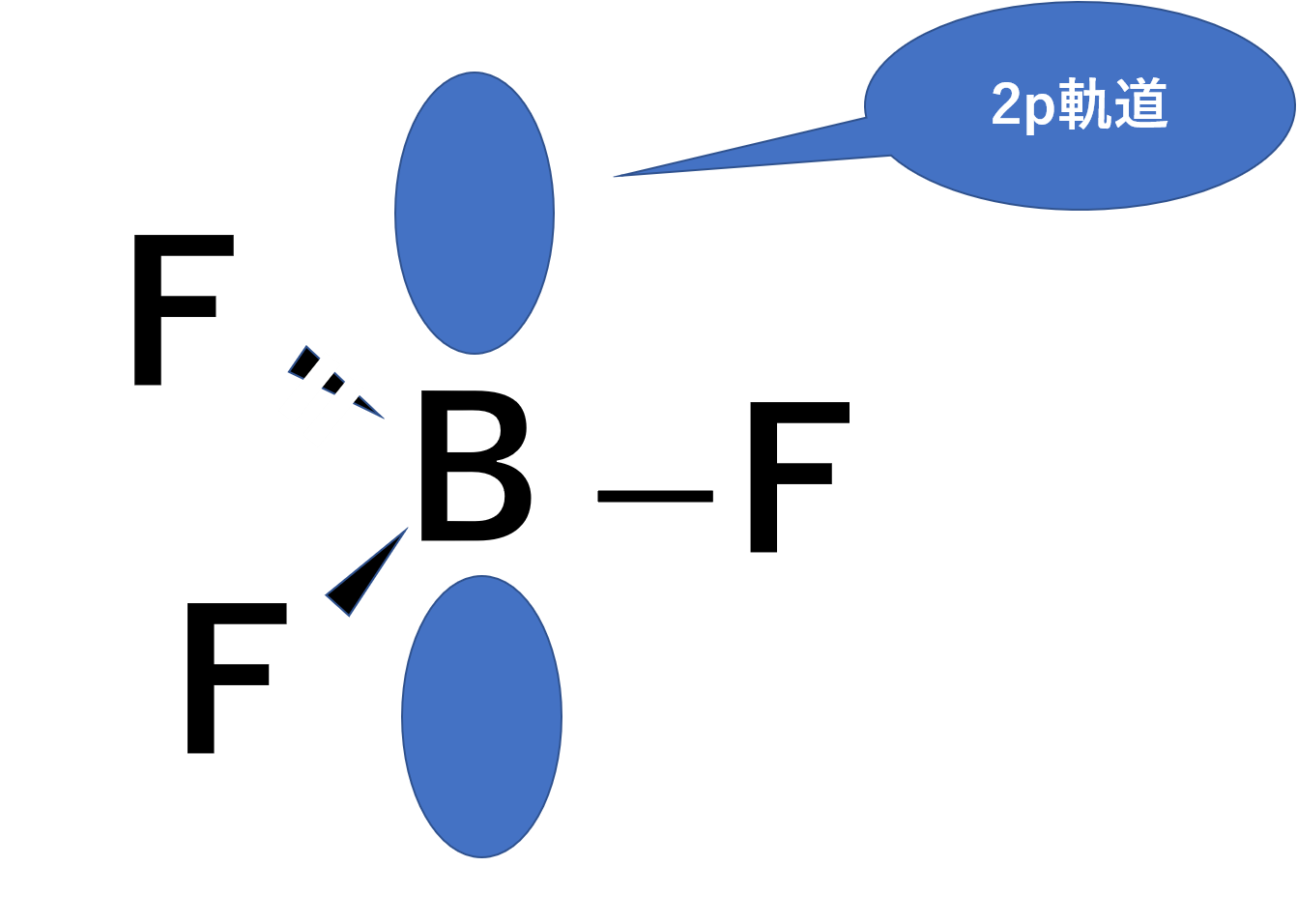
2、アンモニアの窒素原子の混成軌道を答えよ。
アンモニアはNH3であり、さっきの三フッ化ホウ素と一緒でsp2混成軌道じゃないか?と思った方は引っかかっています(笑)混成軌道を考える時は、腕の本数だけでなく電子がどうなっているかも考える必要があります。窒素は原子番号7であるため、まわりに電子を5つ持ちます。
5つの電子のうち3つは水素と握手をしていますが、残りの電子二つは非共有電子対としてsp3混成軌道に存在します。よって、これが答えです。

3、プロパジエンの中央炭素の混成軌道を答えよ。
まずプロパジエンの構造式ですが、プロパンにジエンということなので、H2C=C=CH2となります。これの中央の炭素は両側に二重結合をもっています。二重結合が出てくるときはπ結合でしたね。つまりπ結合が右側と左側にあるため、2つπ結合をもっていることになります。P軌道は3つまでしかないので、残りのp軌道は1つとなります。つまり残りのp軌道1つとs軌道と混成軌道を作っていることになるので、sp混成軌道。これが答えです。
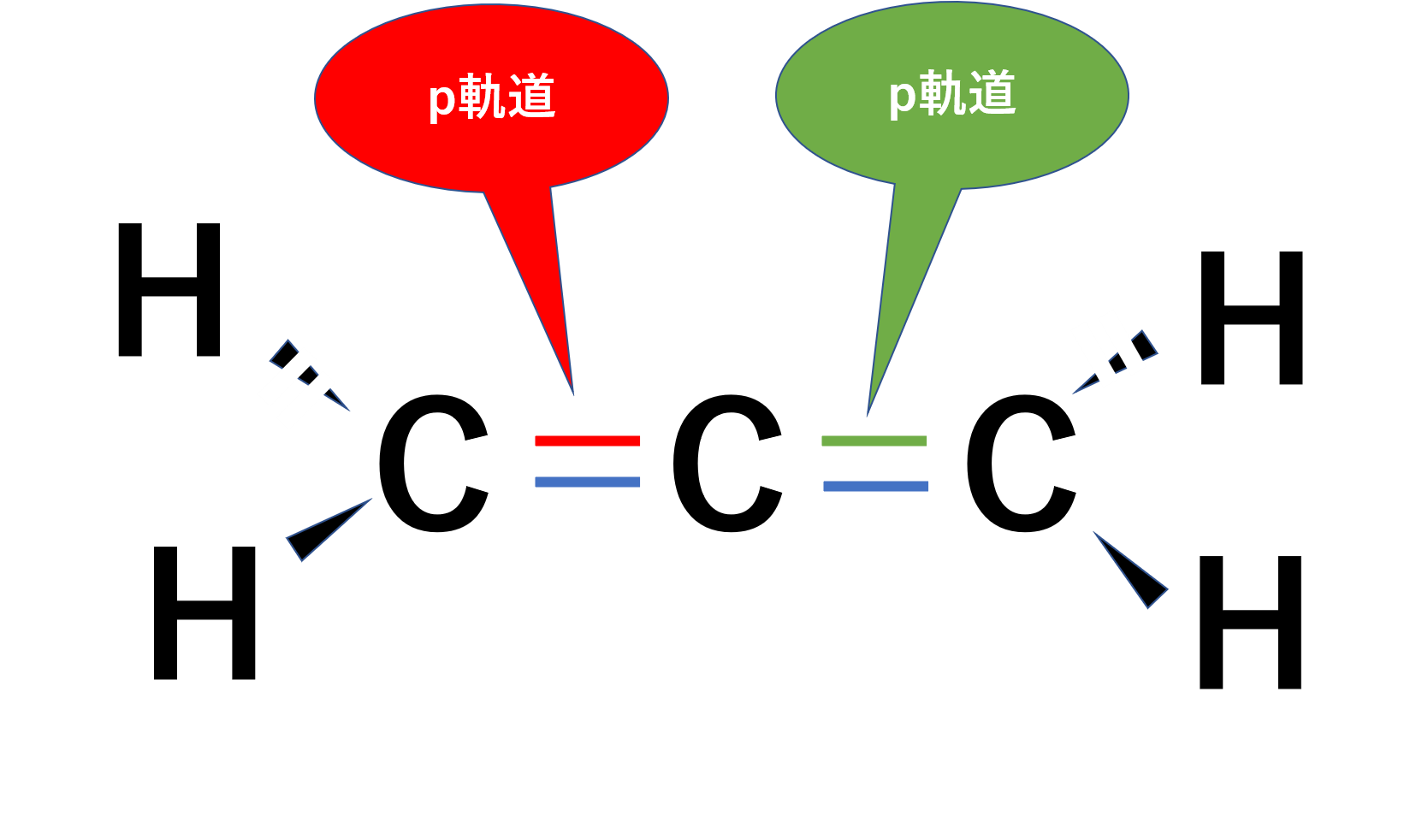
例題を通して、なんとなく混成軌道わかったでしょうか?電子の数と腕の数に注意しましょう。
まとめ
- sp3混成軌道、sp2混成軌道、sp混成軌道を考える時は、電子の数と腕の数に注意しよう。
