

Sponsored Link
Lewis構造式、電子殻と価電子
前回の有機化合物の命名法、官能基が複数ある場合までで命名法の基本を学びました。命名法の際に当たり前のように構造式を使っていましたが、今回はLewis構造式について見ていきます。
Lewis構造式の前に原子について簡単に復習します。おそらく高校でやった内容なので、余裕の人はすっ飛ばしてください。
Sponsored Link
Sponsored Link
原子
原子は惑星のような形をしていて、中央に原子核があり、まわりに電子があります。原子核は陽子と中性子からなります。

これらのうち陽子はプラスに帯電していて中性子は帯電していません。そして電子はマイナスに帯電しています。電子は電子殻と呼ばれるところに存在しています。電子殻は原子核に近いところからK殻、L殻、M殻・・・と呼ばれ、それぞれしまえる最大の電子の数が決まっています。このしまえる最大数は2n2(2の二乗)となります。例えば、K殻では2個、L殻では8個、M殻では18個となります。
基本的に、内側の電子殻ほどエネルギー準位が低いため、電子は内側からしまわれていきます。例えば周期表の水素からネオンまでは以下のように電子がしまわれます。

Lewis構造式
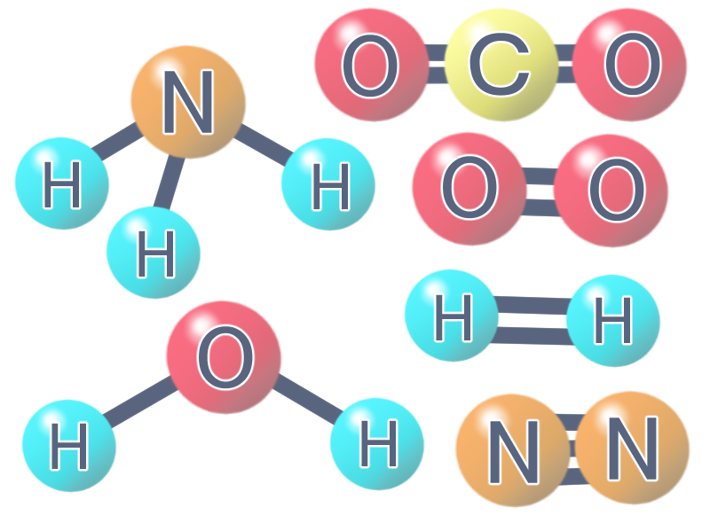
先ほどの電子殻は内側の電子殻の方がエネルギー準位が低いという話をしましたが、逆を返せば外側の電子であるほどエネルギー準位が高いため反応を起こしやすいと言えます。この一番外側にある電子は価電子と呼ばれます。前回までの命名法では、原子同士の結合を線で表しましたが、この価電子を点として表現する構造式をLewis構造式と言います。例えば、水素、炭素、窒素、酸素などはLewis構造式で表すと以下のようになります。

アルカンで学んだメタンはCH4という構造式をとりましたが、これをLewis構造式で表すと以下のようになります。

炭素は価電子が4個であり、水素は価電子1です。原子は最外殻電子が埋まると安定化するため、価電子1の水素が価電子4の炭素に結合することで安定します。
Lewis構造式はある意味パズル的な要素があるので、組み合わせを考えれば構造式もある程度推測できるようになります。例えばアセトニトリルはC2つ、H3つ、N1つからなるのですが、どのようになるでしょうか?
答えは以下のような図となります。

Lewis構造式の点をつなげると線になるため、アセトニトリルは三重結合を持つことがわかります。
まとめ
- 原子は陽子、中性子、電子からなる。
- 電子は電子殻にしまわれ、その最大数は2n2(2の二乗)となる。
- Lewis構造式は価電子を点として表現する構造式
