

Sponsored Link
ピリジンとピロール、ベンゼンとの反応性の違い
前回のオルト、パラ(o、p)配向性、メタ(m)配向性では、ベンゼンの求電子置換反応の配向性について見ました。今回は芳香族の別の例としてピリジンやピロールの反応性について見ていきます。

国家試験的には、ベンゼンと比べて反応性が高いのか低いのか、また置換基がどこにつくのかというのが大事になってきます。
ピリジン
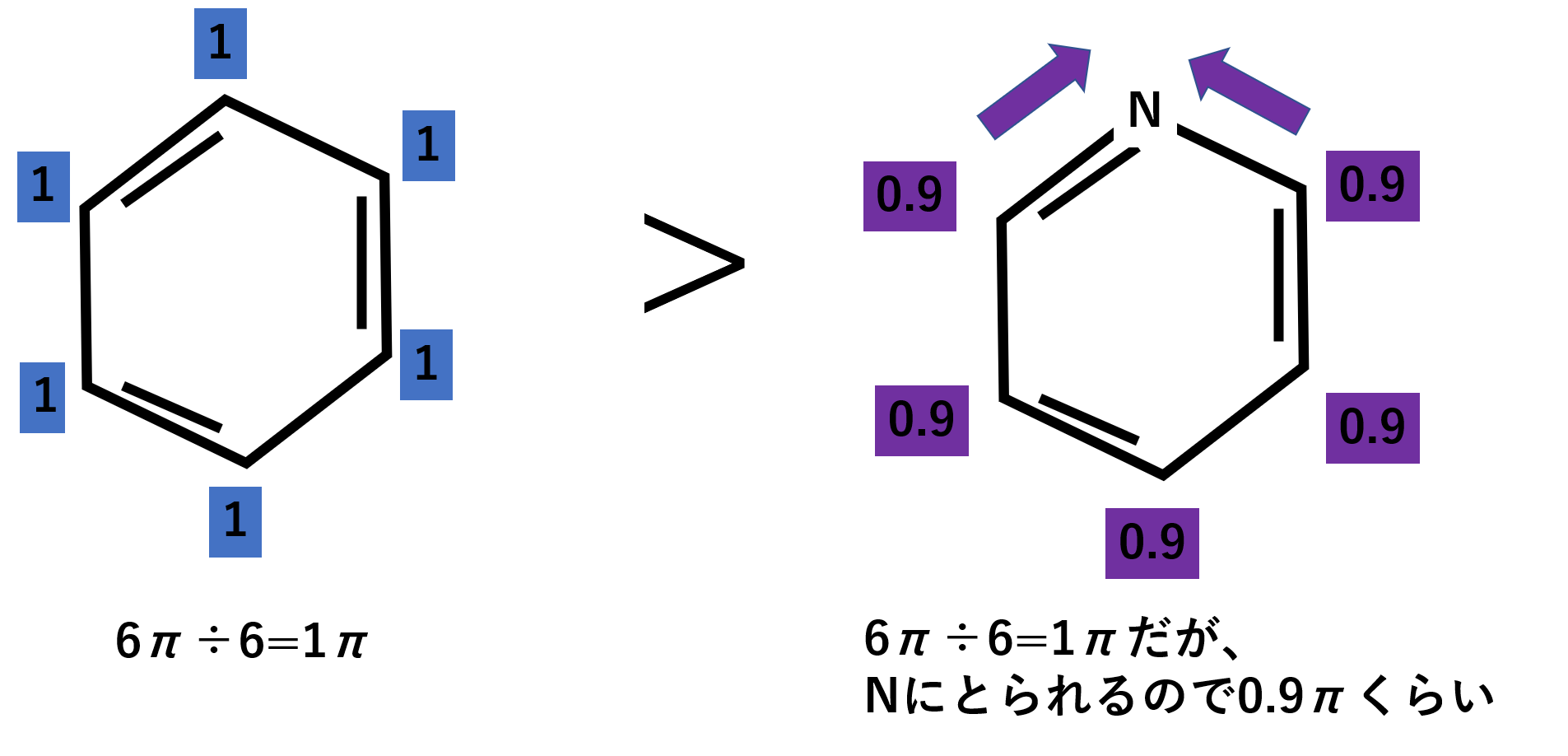
ピリジンはベンゼンの炭素1個が窒素に置き換わった構造をしています。ピリジンは電気陰性度が大きい窒素に置き換わっているため、ベンゼンに比べて電子をとられます。イメージとしてはベンゼンの全体のπ電子を6πとすると、6個の炭素で割るので炭素1個あたりは1πとなります。それに対してピリジンも同じようなイメージで考えると、6π÷6=1πですがNに電子をとられるので炭素1個あたり0.9πのような感じです。よって、反応性はベンゼンに比べるとピリジンは低くなります。
またピリジンにつく置換基ですが、3位で起こりやすくなります。前回同様に中間体のカチオンの安定性を考えます。
まず2位や4位についた場合の共鳴構造をみてみると、電気陰性度が大きい窒素がプラスとなっている構造があります。これは不安定です。
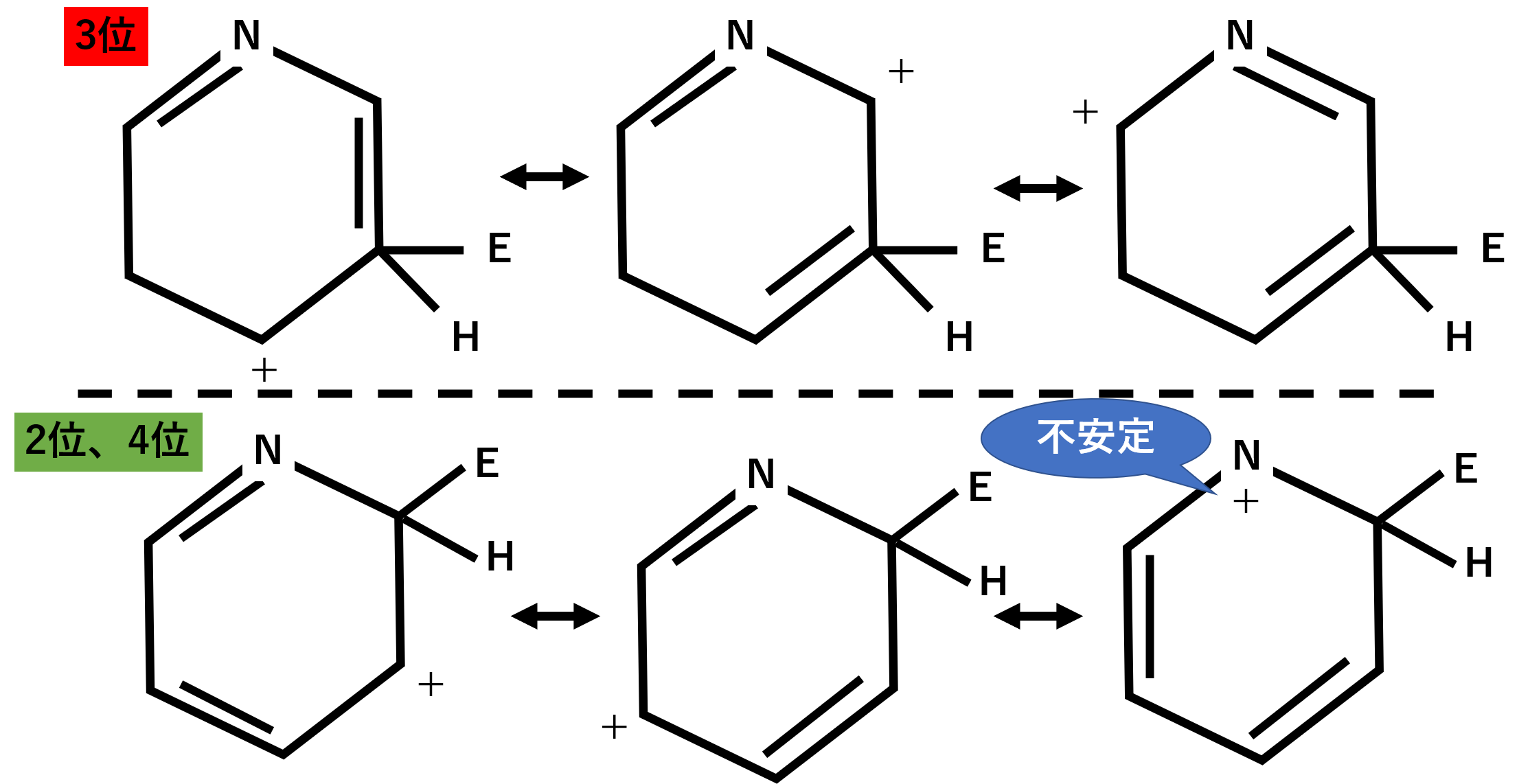
それに対して3位についた場合の共鳴構造は、窒素がプラスになる構造は含みません。
以上のことから不安定な共鳴構造を含まない3位に求電子置換反応が起こりやすくなります。
Sponsored Link
Sponsored Link
ピロール
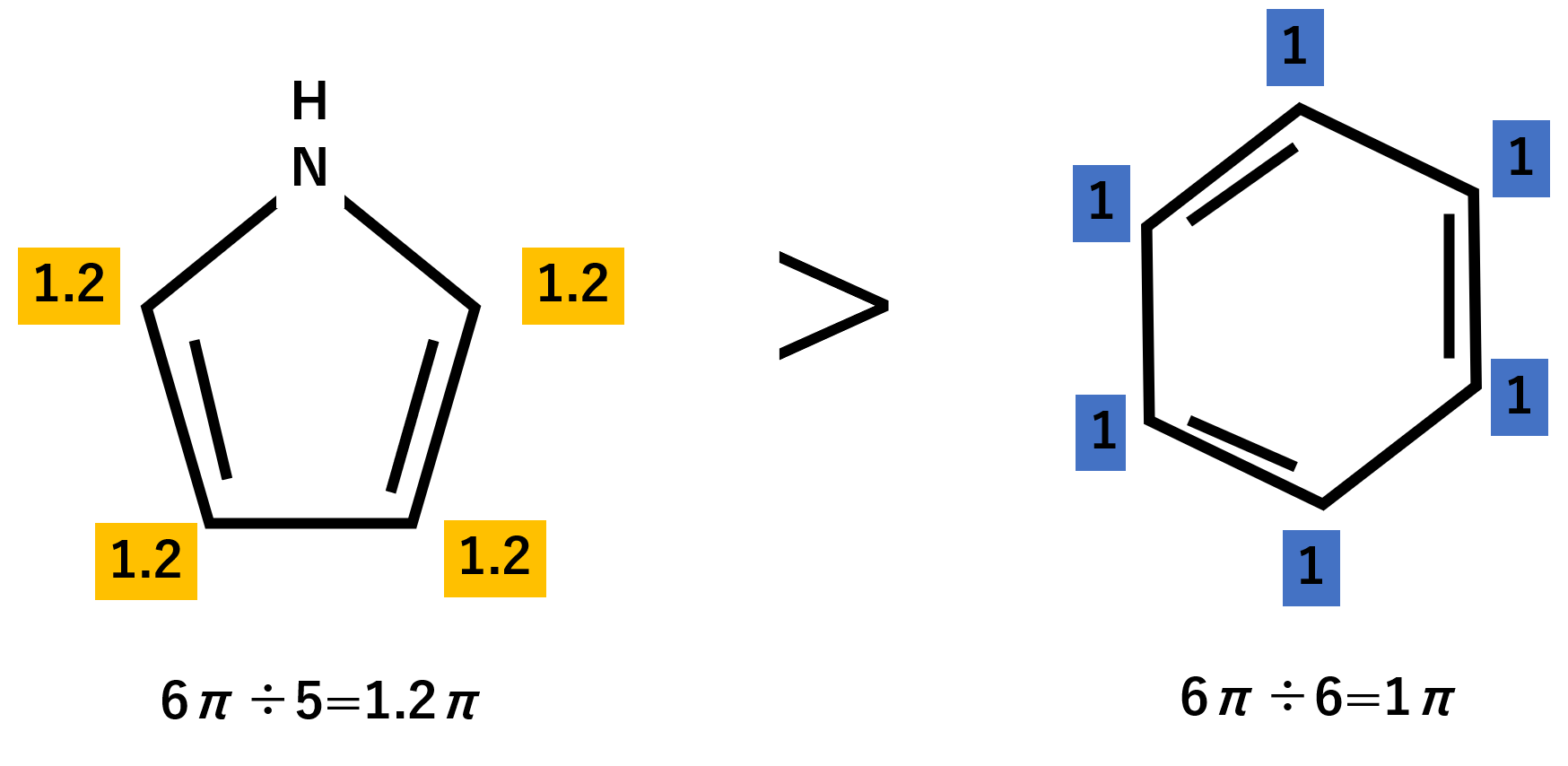
ピロールは5員環で、1つがNHとなっています。先ほどのピリジンと同じように考えると、ピロールの窒素の非共有電子対はp軌道に入っているので6π÷5=1.2πのようなイメージを持つことができます。よってベンゼンより電子が濃い状態と言え、反応性はベンゼンよりピロールの方が高くなります。
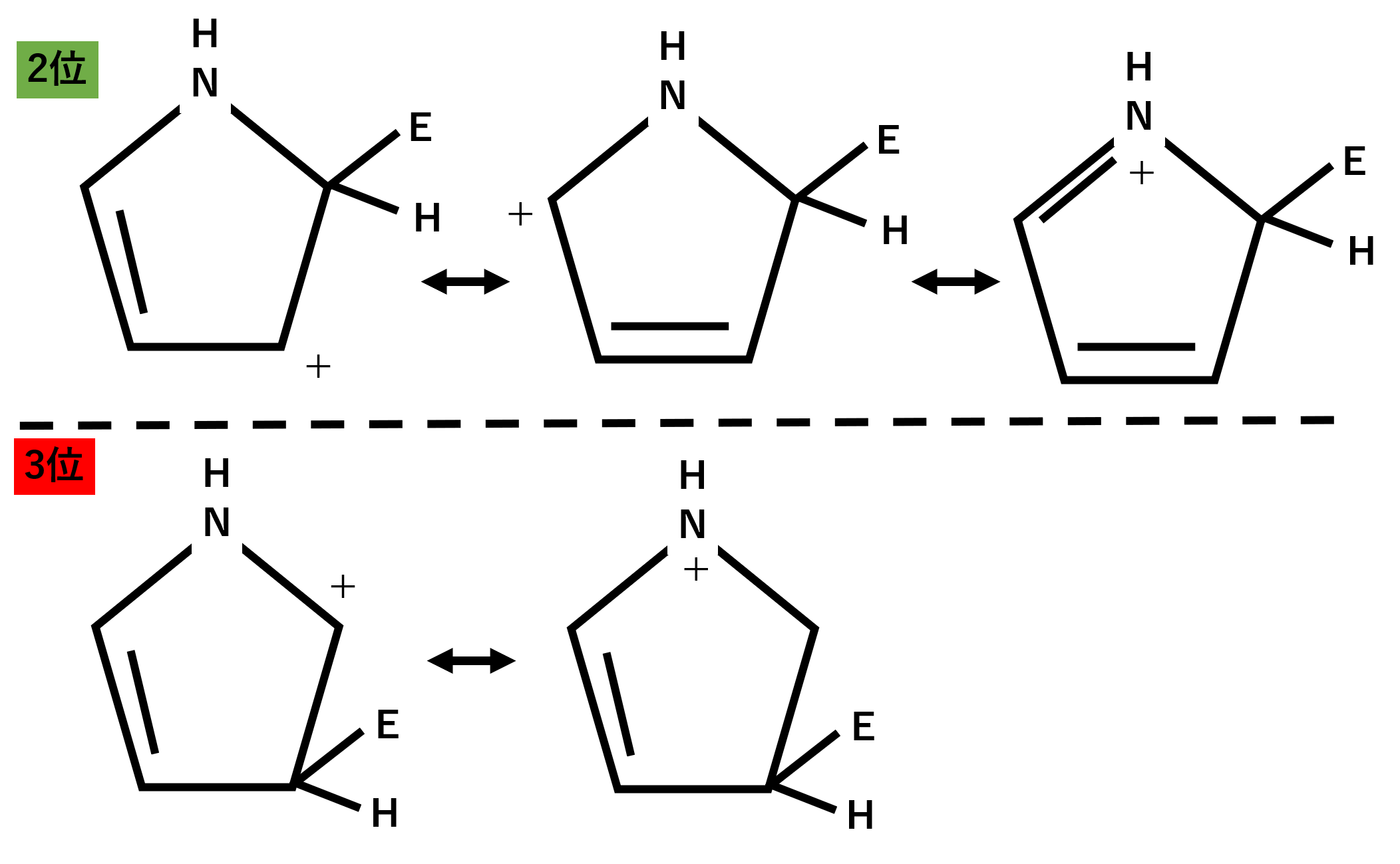
そしてピロールにつく置換基は2位で起こりやすくなります。
2位についた場合、共鳴構造を3個書くことができます。それに対して3位についた場合は共鳴構造を2個しか書くことができません。共鳴構造はより多く書ける方が安定なので、2位となります。
理論的に抑えたところで、久しぶりのピリジンとピロールの反応性のゴロです。
- ぴろ兄(にい)はべっぴんさん好き
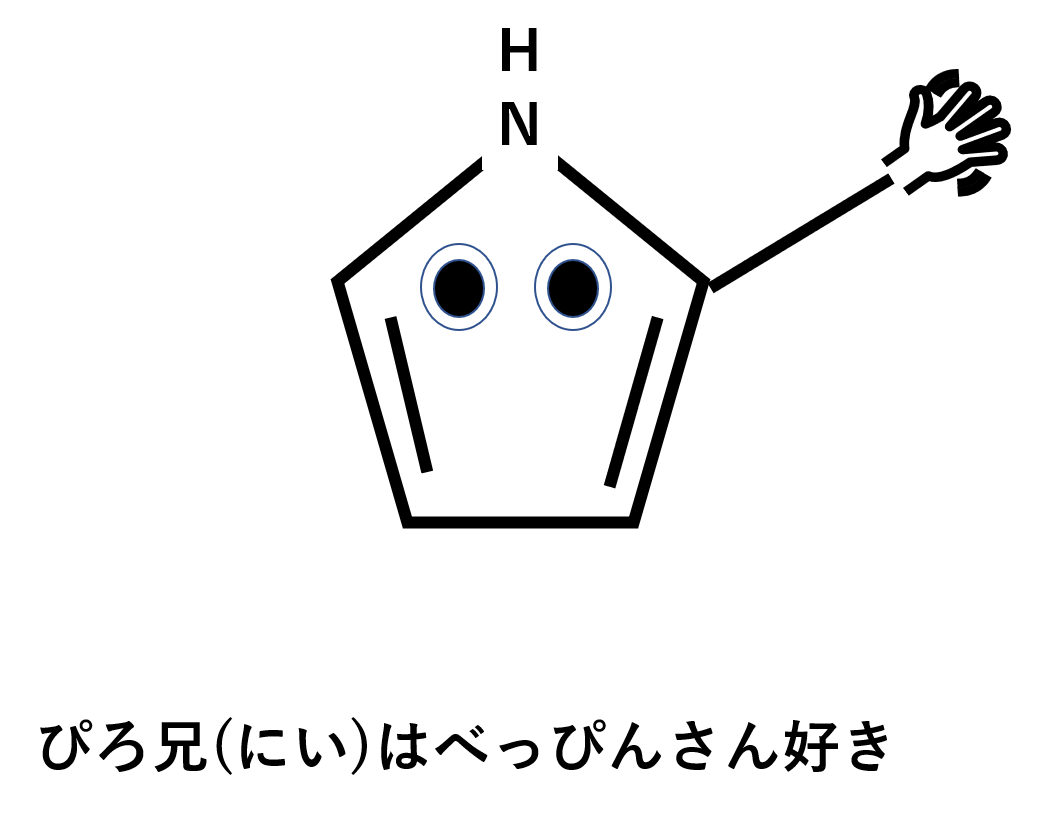
- ぴろ;ピロール
- 兄(にい);2位
- ぴん;ピリジン
- さん;3位
イメージ作りの物語を。ベンゼン君の兄貴分のぴろ兄は、NHモヒカンを持つナイスガイです。そんなぴろ兄はべっぴんさんが大好きという話です。ぜひぴろ兄を何度も書いて覚えてください(笑)
まとめ
- 反応性は、ピロール>ベンゼン>ピリジン
- ピリジンは3位、ピロールは2位に求電子置換反応が起こる
