

Sponsored Link
有機化合物の命名法、アルカンとアルキル基
薬剤師は化学的に薬を見ることのできる医療職です。現場では忙しさのあまり使う機会がなかなかありませんが、基礎知識をつけておくことは大事なことです。このカテゴリーでは主に有機化学を見ていきます。
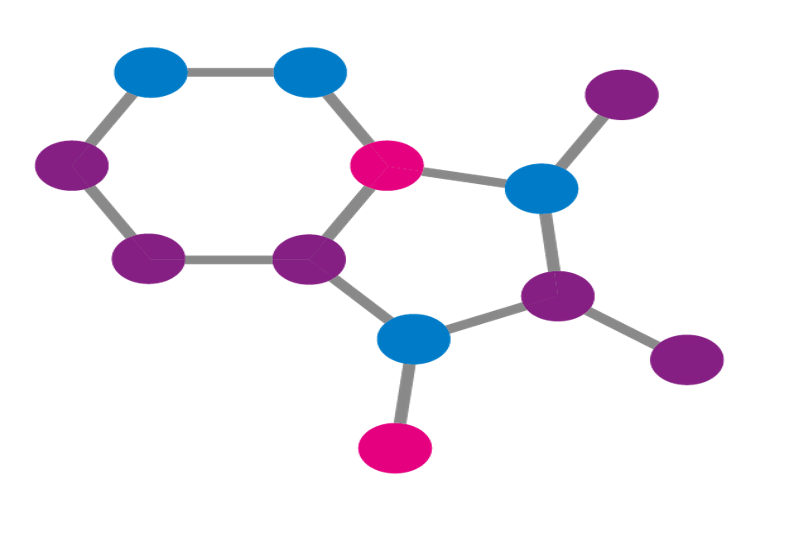
まず薬はそれぞれ名前がつけられていて、例えばアスピリン、カロナール、ロキソニン・・・など多くの名前がついています。しかしこれは商品名であり、実際にどのような構造式を持つのかわかりません。そこで誰もが名前を見ただけで構造式を書けるように名前を付ける必要があり、そのルールをまとめたものが命名法となります。今回は有機化合物の命名法のうちアルカンについて見ていきます。
Sponsored Link
Sponsored Link
命名法
結論から言って申し訳ないですが、化合物の命名は以下のようになっています。
- 接頭語(置換基)+[語幹(最長の炭素鎖)+語尾(最も優先順位の高い官能基)]
あとでこれは例題を見ながら確認するのでとりあえず全体像はこうなるということだけここでは覚えてください。そして、命名法をやっていくうえでどうしても覚えなければならないのが以下のものです。
- 数詞
- アルカン
- アルキル基
数詞
命名法における数詞はギリシャ語が使われます。
- 1;モノ
- 2;ジ
- 3;トリ
- 4;テトラ
- 5;ペンタ
- 6;ヘキサ
- 7;ヘプタ
- 8;オクタ
- 9;ノナ
- 10;デカ
これは10までは頑張って覚えてください。いつものようにゴロはないので、何度も唱えて覚えてください。これが覚えられなければ、この先死ぬほど出てくるので薬学部は引退した方がいいです(笑)
アルカン
炭素原子が鎖状につながったものをアルカン(alkane)と言います。アルカンはCnH2n+2という式になります。このnの数によって以下のようになります。
- 1;メタン
- 2;エタン
- 3;プロパン
- 4;ブタン
- 5;ペンタン
- 6;ヘキサン
- 7;ヘプタン
- 8;オクタン
- 9;ノナン
- 10;デカン
これも10までは死んでも覚えてください。5以降は数詞と名前がにていて、数詞+ane(アルカンのアン)という形になっています。
アルキル基
アルカンから水素原子を1つ外した炭化水素をアルキル基と言います。アルキル基なので、語尾が〜ルに変わります。
- 1;メチル
- 2;エチル
- 3;プロピル
- 4;ブチル
- 5;ペンチル
- 6;ヘキシル
- 7;ヘプチル
- 8;オクチル
- 9;ノニル
- 10;デシル
ここまで頑張って覚えられたら下準備完了です。例題を見てみましょう
例題1
次の有機化合物の命名をせよ
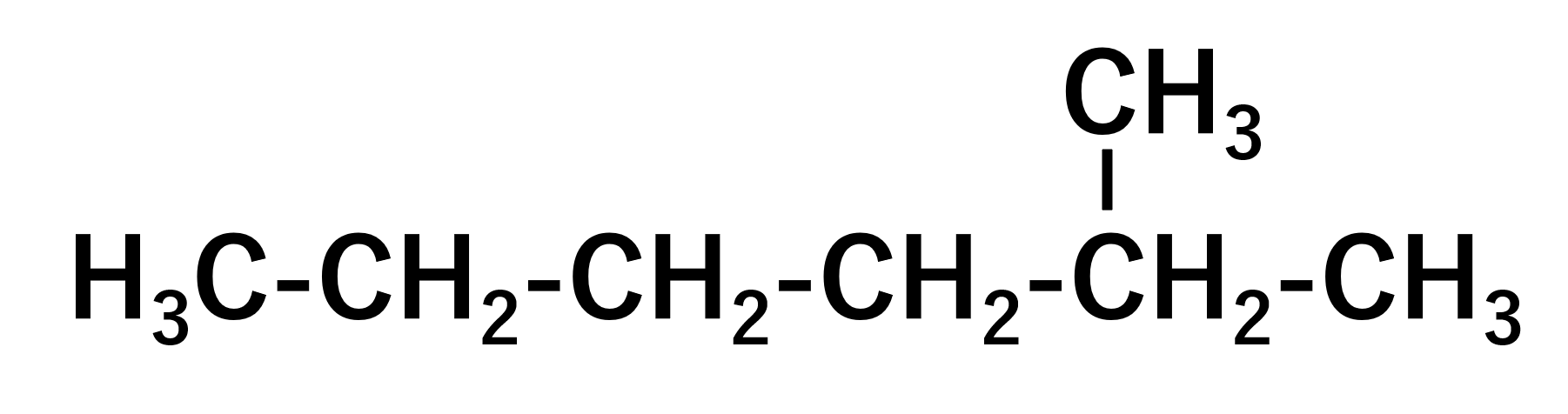
冒頭の命名法のルールである、接頭語(置換基)+[語幹(最長の炭素鎖)+語尾(最も優先順位の高い官能基)]を思い出してください。
基本的には母体に何かがくっついているという形をとるので、まず母体を探します。母体は一番長い炭素鎖を持ち、炭素6個が最長となります。まだここでは語尾(最も優先順位の高い官能基)というのは、アルカンしか学んでいないため、これはヘキサンであることがわかり、これで母体は完了です。

次に接頭語(置換基)ですが、この置換基の数字が小さくなるように名前をつけなければなりません。左から数えると5、右から数えると2になります。よって右から番号をつけるのが正しくなり、接頭語(置換基)は2-メチルとなります。
最後にこれらをくっつけて、2-メチルヘキサン。これが正解です。
もう1題例題を見てみましょう。
例題2
次の有機化合物の命名をせよ
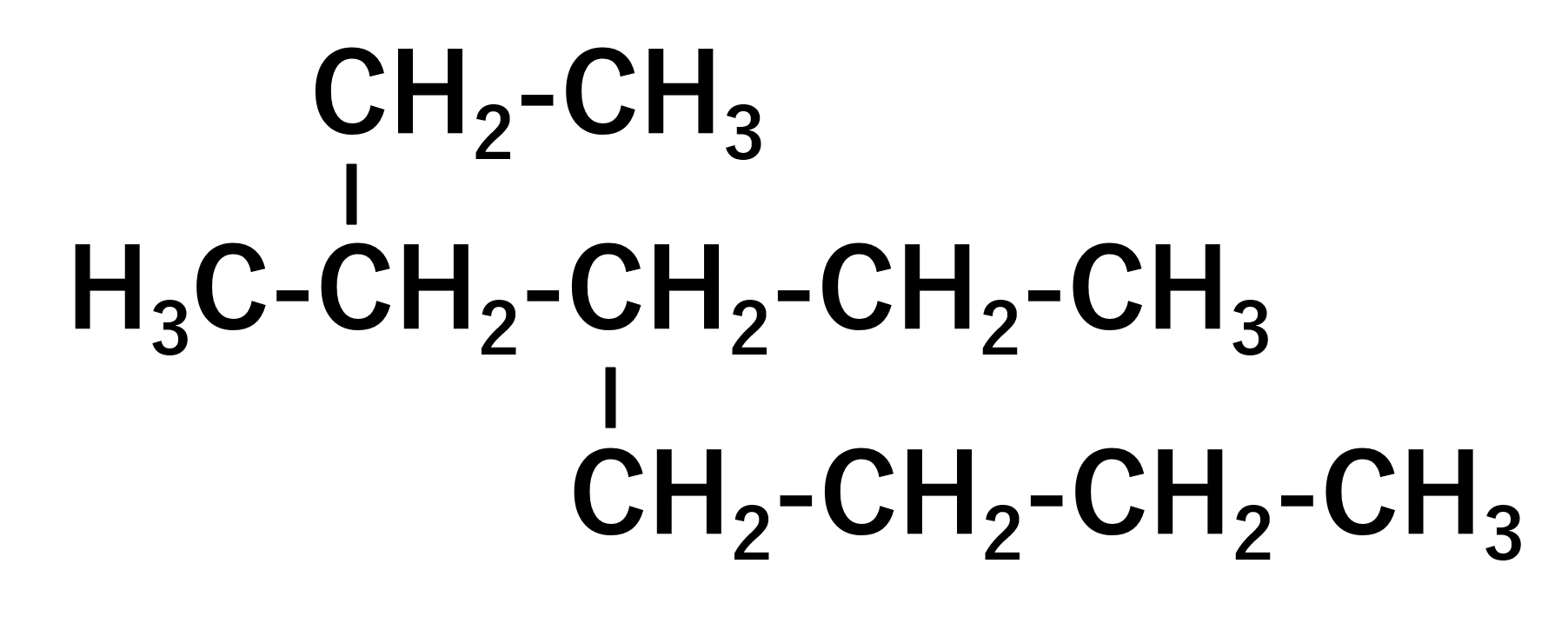
色々枝が生えていますが、やることは同じです。まず母体を探します。見ていくと最長の炭素は8個です。よって、これはオクタンと判断することができます。
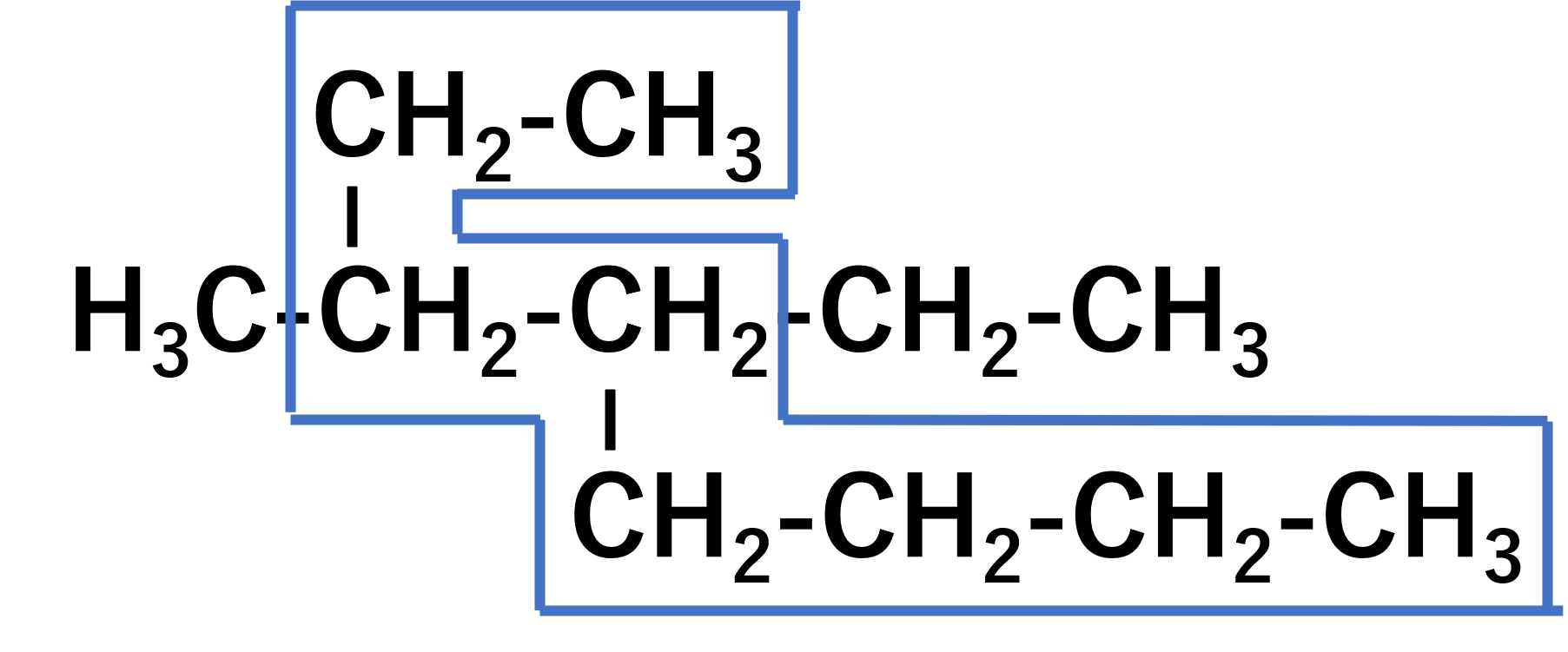
次に置換基です。今回は置換基が2つついています。まず置換基の数字を小さくしなければなりませんから、3-メチルと4-エチルということになります。最後にこれらを合わせますが、ここで追加のルールとして、メチルとエチルだと、アルファベット順で早い方を置くため、mよりeの方が早いです。よってエチルを前に書きます。
よって、4-エチル-3-メチルオクタン。これが正解です。
最後にもう1問行きましょう。
例題3
次の有機化合物の命名をせよ
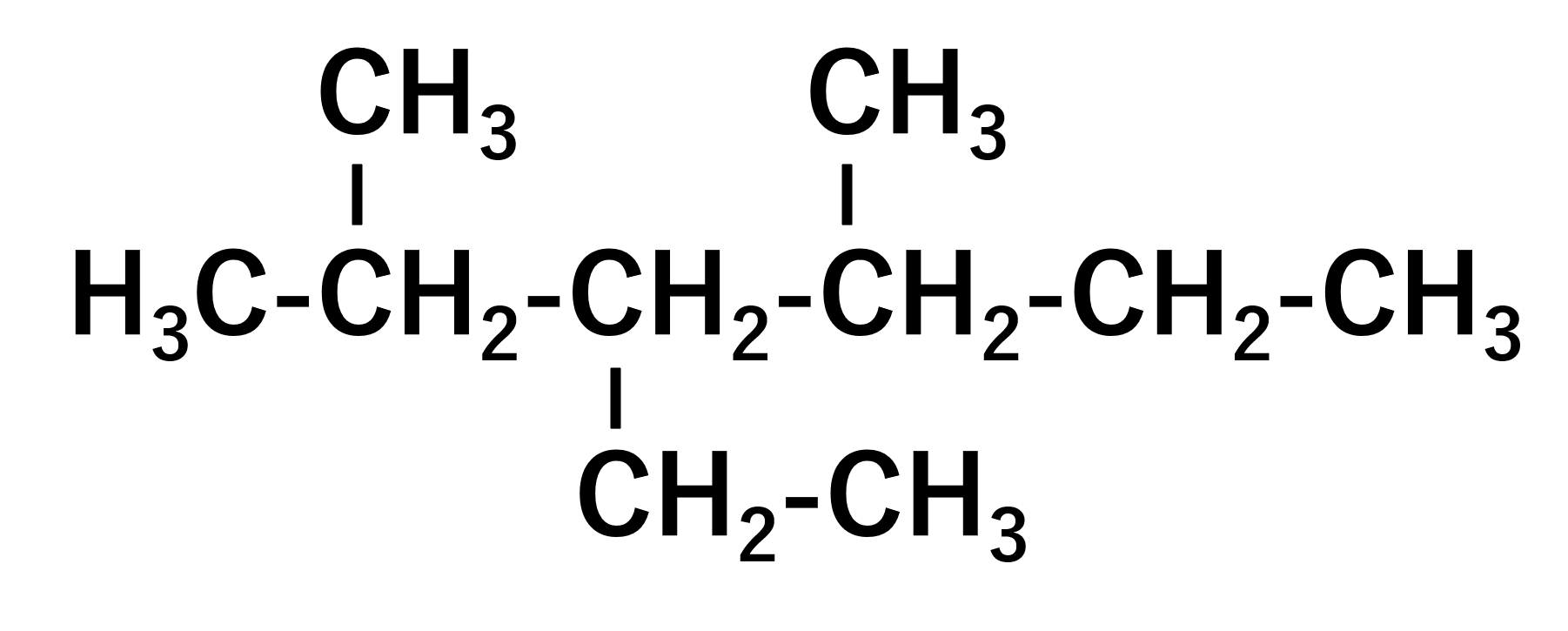
母体を探すと、ヘキサンであることがわかります。次に置換基ですが、これは3つあることがわかり、左から数字をつけると小さくなります。問題はメチル基が2つあり、これをどう名前をつけるかです。この場合は倍数接語というものがあって、
- 2;ジ
- 3;トリ
- 4;テトラ
- 5;ペンタ
となっています。これはテトラくらいまで覚えられていたら問題ないと思います。これを使いメチル基を表現すると、2,4-ジ-メチルとなります。あとは3-エチルと合わせて、
3-エチル-2,4-ジ-メチルヘキサン。これが答えです。
まとめ
- 有機化合物の命名法のうち数詞、アルカン、アルキル基は最低でも覚えましょう。
