

Sponsored Link
電気陰性度、イオン化エネルギー、電子親和力、周期表のゴロ
前回のs軌道、p軌道、d軌道とエネルギー準位では、電子の軌道について見ました。これらは化学結合に関わるという話をしましたが、もう1つ知っておくべきことがあります。それは電気陰性度、イオン化エネルギー、電子親和力です。今回はこれらを見ていきます。
今回は高校の内容なので、すっ飛ばす方はすっ飛ばしてください。
まず電気陰性度、イオン化エネルギー、電子親和力を見る前に周期表について見ていきます。
Sponsored Link
Sponsored Link
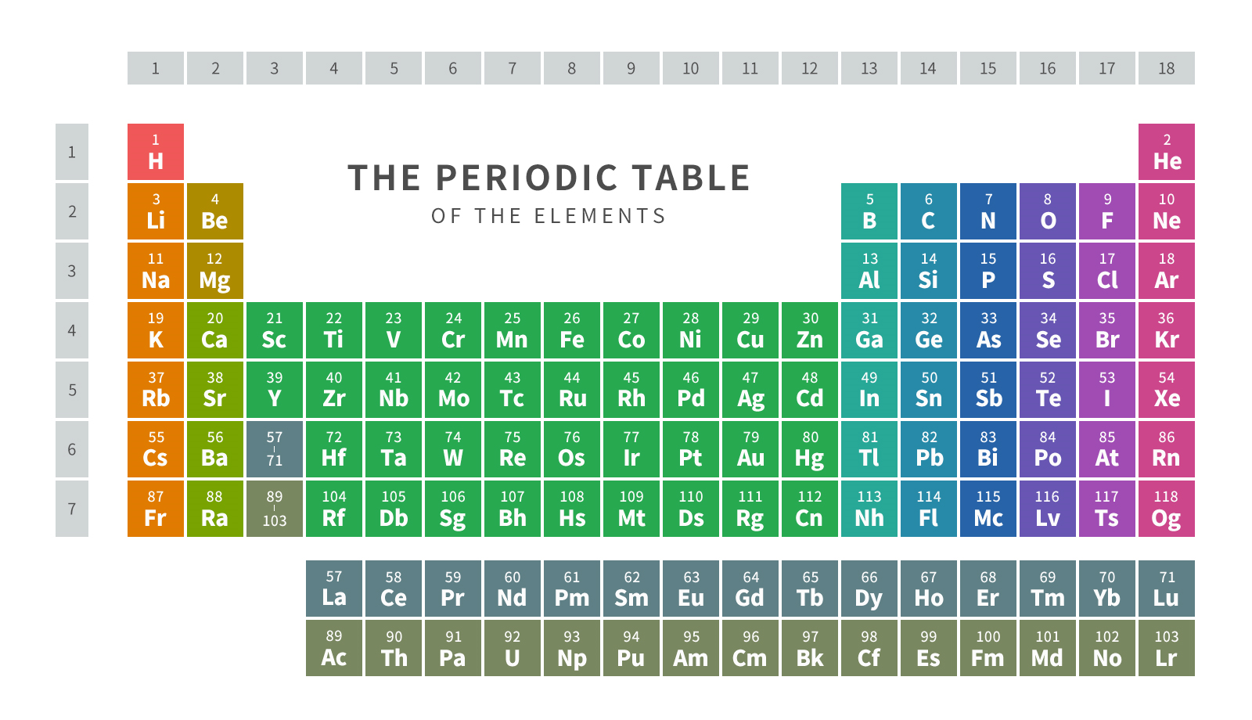
周期表
周期表はもはや言うまでもないですが、冒頭の図のように元素の性質が一定の法則で示されるように並べたものです。高校時代に全部言える変態的な友達がいましたが、国家試験的には全部覚えなくても問題ないと思います。ちなみに私は高校までの水素〜クリプトンまでで何も新しいことは大学時代追加しませんでした。(笑)
もうご存じだったり、別のゴロで覚えていたりするかもしれませんが、一応私の高校の時のゴロを紹介しておきます。
- 水兵リーベ、ぼくのおふね。名前がある「シップスクールアールケカ」。

- 水;水素
- 兵;ヘリウム
- リ;リチウム
- ベ;ベリリウム
- ぼ;ホウ素
- く;炭素
- の;窒素
- お;酸素
- ふ;フッ素
- ね;ネオン
- 名;ナトリウム
- 前が;マグネシウム
- ある;アルミニウム
- シッ;ケイ素
- プ;リン
- ス;硫黄
- クール;塩素
- アール;アルゴン
- ケ;カリウム
- カ;カルシウム
イメージ作りの物語を。水兵のリーベは、自分で船を持っていました。その船の名前がシップスクールアールケカだったというお話です。
- スカンク千葉のクマ、徹子にどう会える。

- スカンク;スカンジウム
- 千;チタン
- 葉;バナジウム
- ク;クロム
- マ;マンガン
- 徹;鉄
- 子;コバルト
- に;ニッケル
- どう;銅
- 会える;亜鉛
カルシウムからの続きです。スカンクと千葉のクマがいましたが、〇柳徹子のファンで、どうすれば会えるだろうと話し合っているというお話です。
- ガリガリギャル、あっせればシュークリーム。

- ガリガリ;ガリウム
- ギャル;ゲルマニウム
- あっ;ヒ素
- せ;セレン
- れば;ルビジウム
- シュー;臭素
- クリーム;クリプトン
亜鉛からの続きです。ガリガリのギャルがいました。あっと口をあけてシュークリームを食べているというお話です。
電気陰性度、イオン化エネルギー、電子親和力
周期表をざっと確認したところで、いよいよ電気陰性度、イオン化エネルギー、電子親和力です。まず定義からです。
- 電気陰性度;原子が共有結合している相手の原子から電子をひきつけようとする傾向のこと。電気陰性度が大きいほど電子を引き付ける力が強い。
- イオン化エネルギー;原子1個から電子1個を取り去る時に必要なエネルギー。イオン化エネルギーが小さいほど、陽イオンになりやすい。
- 電子親和力;原子1個が電子1個を取り入れる時に放出されるエネルギー。電子親和力が大きいほど、陰イオンになりやすい。
電気陰性度、イオン化エネルギー、電子親和力は先ほどの周期表で右上ほど強くなります。ただ電気陰性度と電子親和力は希ガスを除きます。これは希ガスがすでに安定状態であることを考えればわかると思います。

そして電気陰性度は右上ほど強くフッ素が最強となりますが、右と上どちらの方がより電気陰性度が強いのかというのが国家試験的には重要です。つまり窒素と塩素どちらが強いのかという問題です。
これも高校時代のゴロを紹介します。
- 元気良い生徒、ホントに来るよ、合格通知

- 元気良い生徒;電気陰性度
- ホントに来るよ;F>O>N>Cl
イメージ作りの物語を。ある生徒は受験を終え、合格通知を待っていました。その生徒は元気だけがとりえで、自分は受かるだろうかと心配でした。そうしたらなんと合格通知が届いたというお話です。
このゴロからわかるように、塩素より窒素の方が強いことがわかります。
まとめ
- 電気陰性度、イオン化エネルギー、電子親和力は一般的に周期表の右上にいくほど強くなる。
