

Sponsored Link
アルケンの反応1、syn付加とanti付加
今回から反応機構を見ていきますが、たくさん種類があるので何回かにわけて書いていきます。今回はアルケンのsyn付加とanti付加を見ていきます。
今までの基礎知識が総動員されて反応機構となっていくので、基礎知識がわからないままだとただのクソ暗記になってしまうため注意が必要です。
アルケンの付加反応
アルケンはπ結合をもちます。このπ結合が切れて原子が結合する反応を付加反応と呼びます。Π結合がある場合は回転ができないため、sp2混成軌道をもつアルケンは平面として存在するという話を以前しました。このアルケンの平面に対して、結合する原子がどのようにくっつくかによって以下の2つにわけられます。
- syn付加;平面に対して両方とも同じ面に結合
- anti付加;平面に対して1つずつ別の面に結合
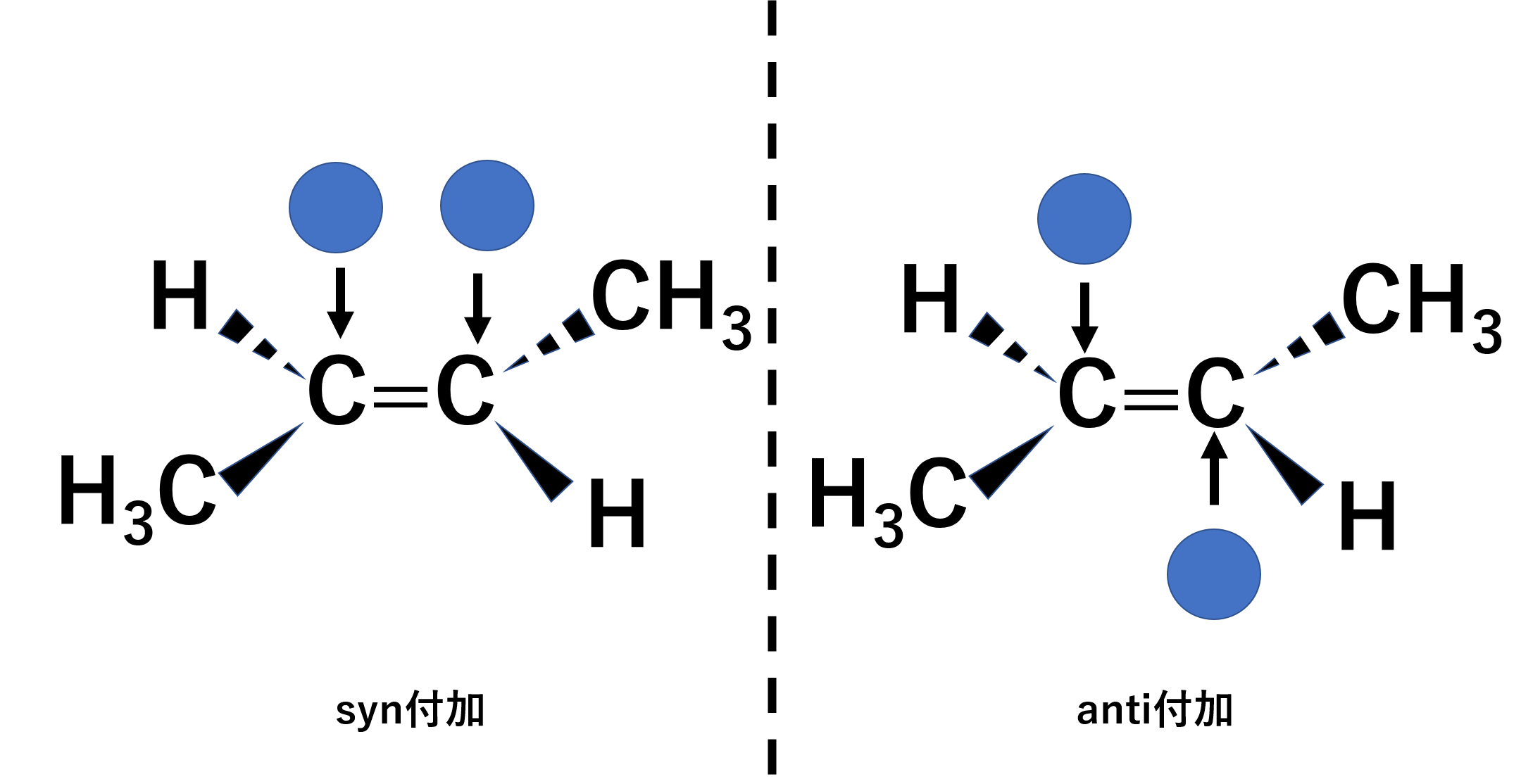
今回はsyn付加とanti付加の代表例の1部を見ていきます。
Sponsored Link
Sponsored Link
ハロゲンの付加
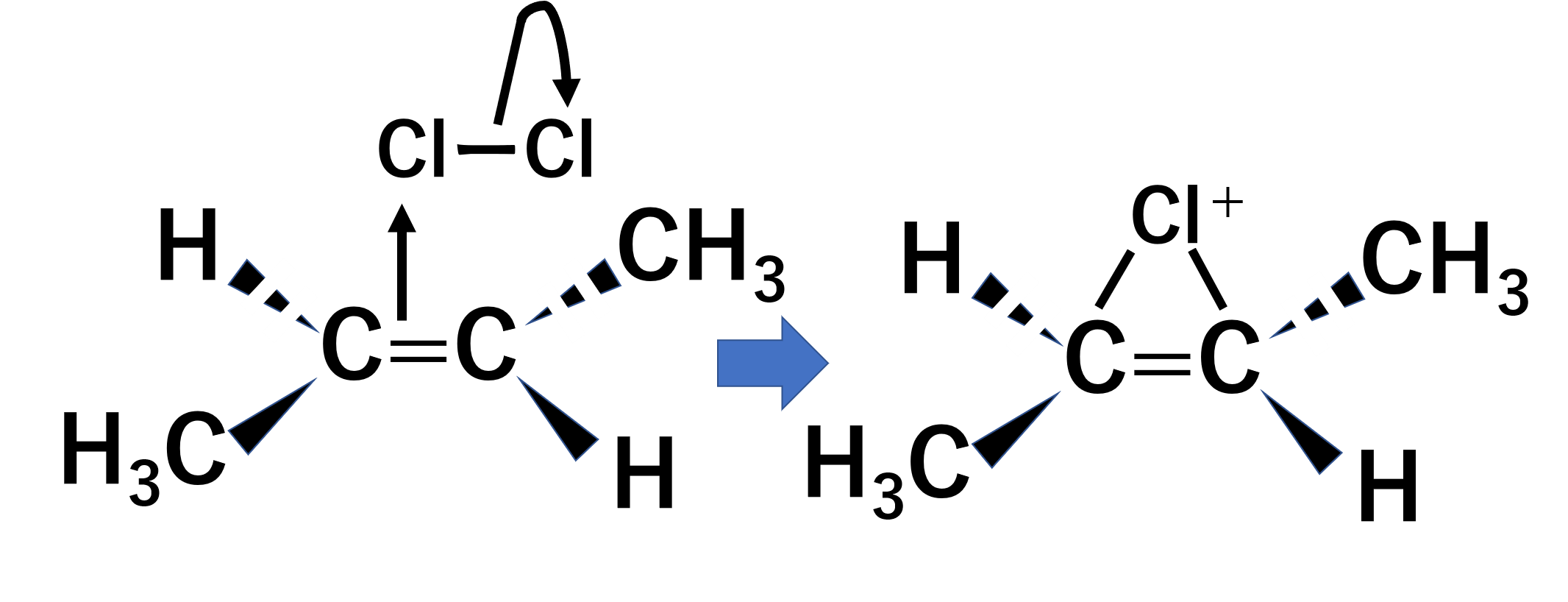
ハロゲンはanti付加します。trans-ブタ-2-エンのハロゲンの付加の例を見てみましょう。
まずtrans-ブタ-2-エンのπ結合が、上側から塩素の片方に攻撃をし環状化合物を作ります。塩素は電気陰性度が高いため、電子を引き寄せようとします。そのため攻撃を受けた塩素は単結合を切り塩化物イオンが生じます。
次に塩化物イオンは下側から炭素に攻撃します。すると、環状化合物の単結合が切れてCl+に電子が入ります。
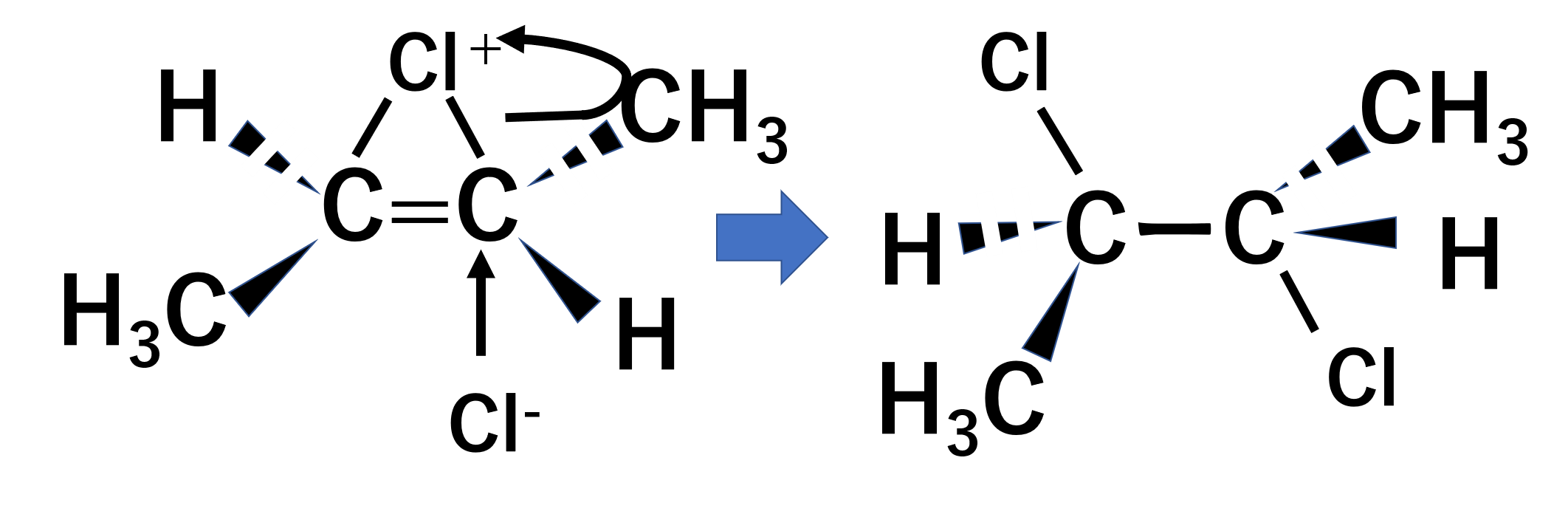
このような電子の動きが基本となってくるので、これを叩き込んだうえで他の反応も見てみましょう。
接触水素化
水素はsyn付加します。trans-ブタ-2-エンの接触水素化の例を見てみましょう。
PdやPtなどの金属触媒がある状態で水素と反応させると、水素がsyn付加します。
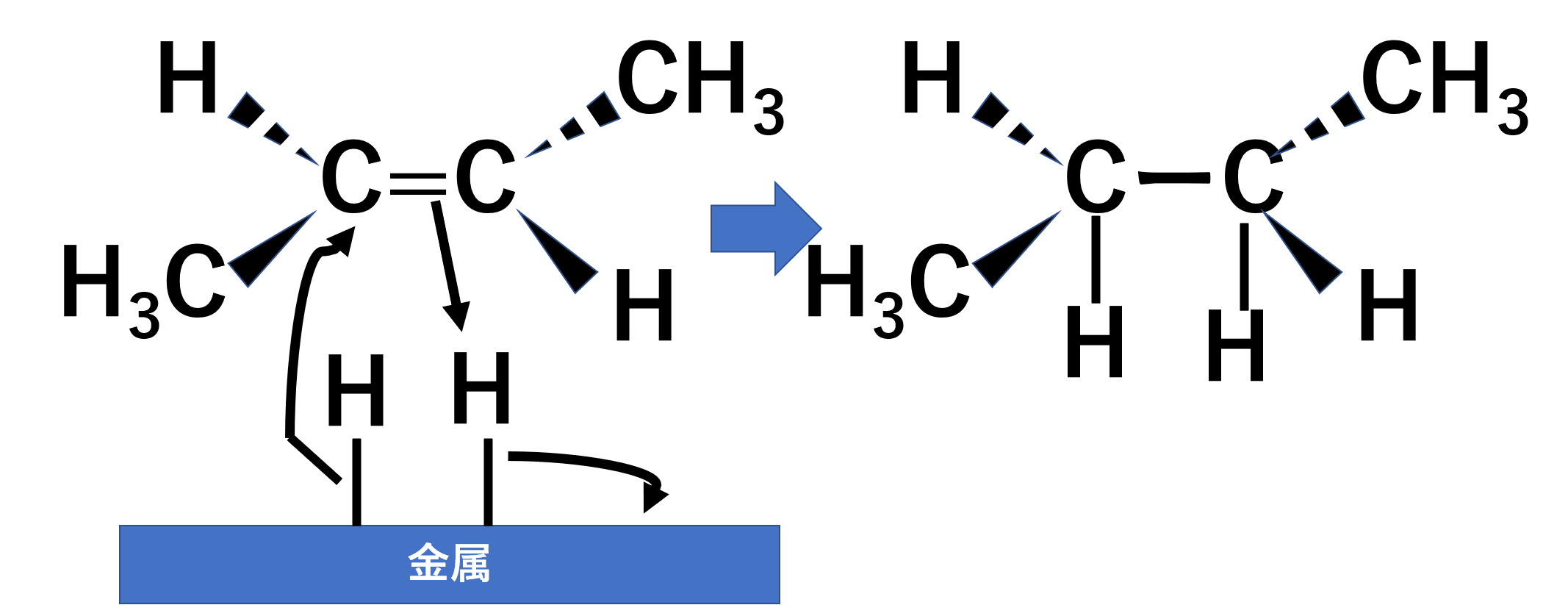
1,2-ジオール化
OHがsyn付加します。trans-ブタ-2-エンの1,2-ジオール化の例を見てみましょう。
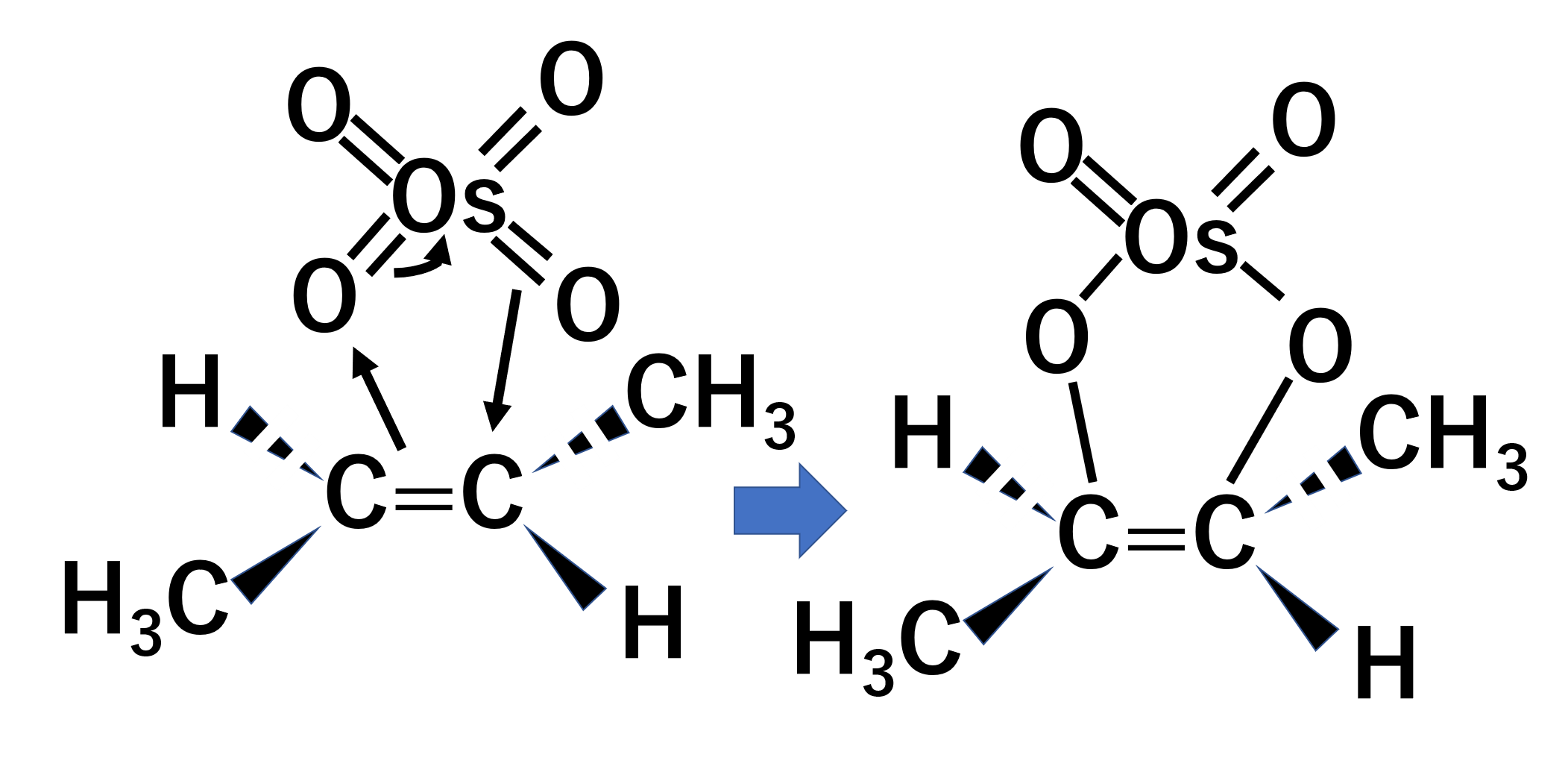
アルケンのπ結合が四酸化オスミウムを攻撃して環状化合物を作ります。
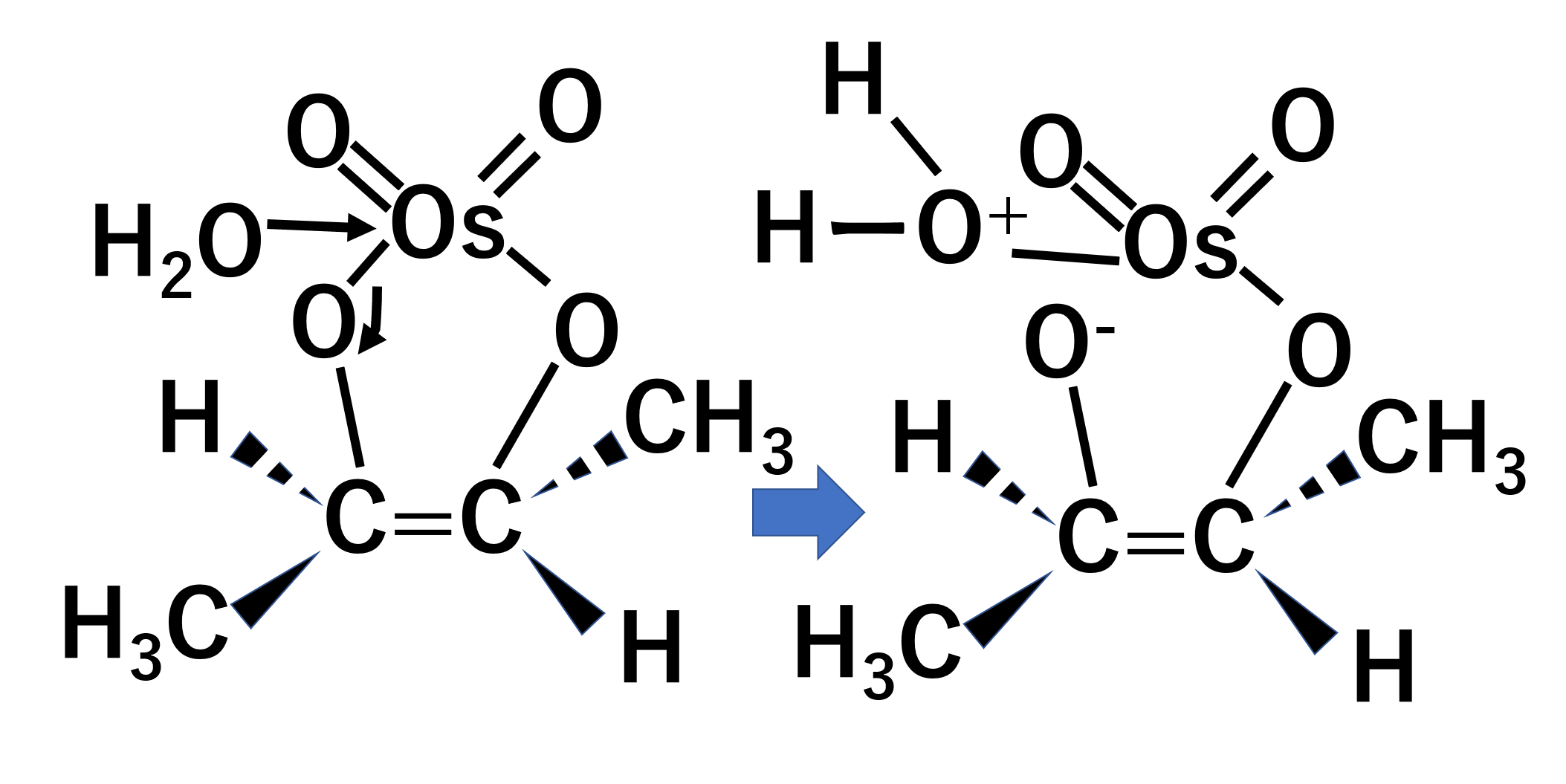
その後水と反応します。
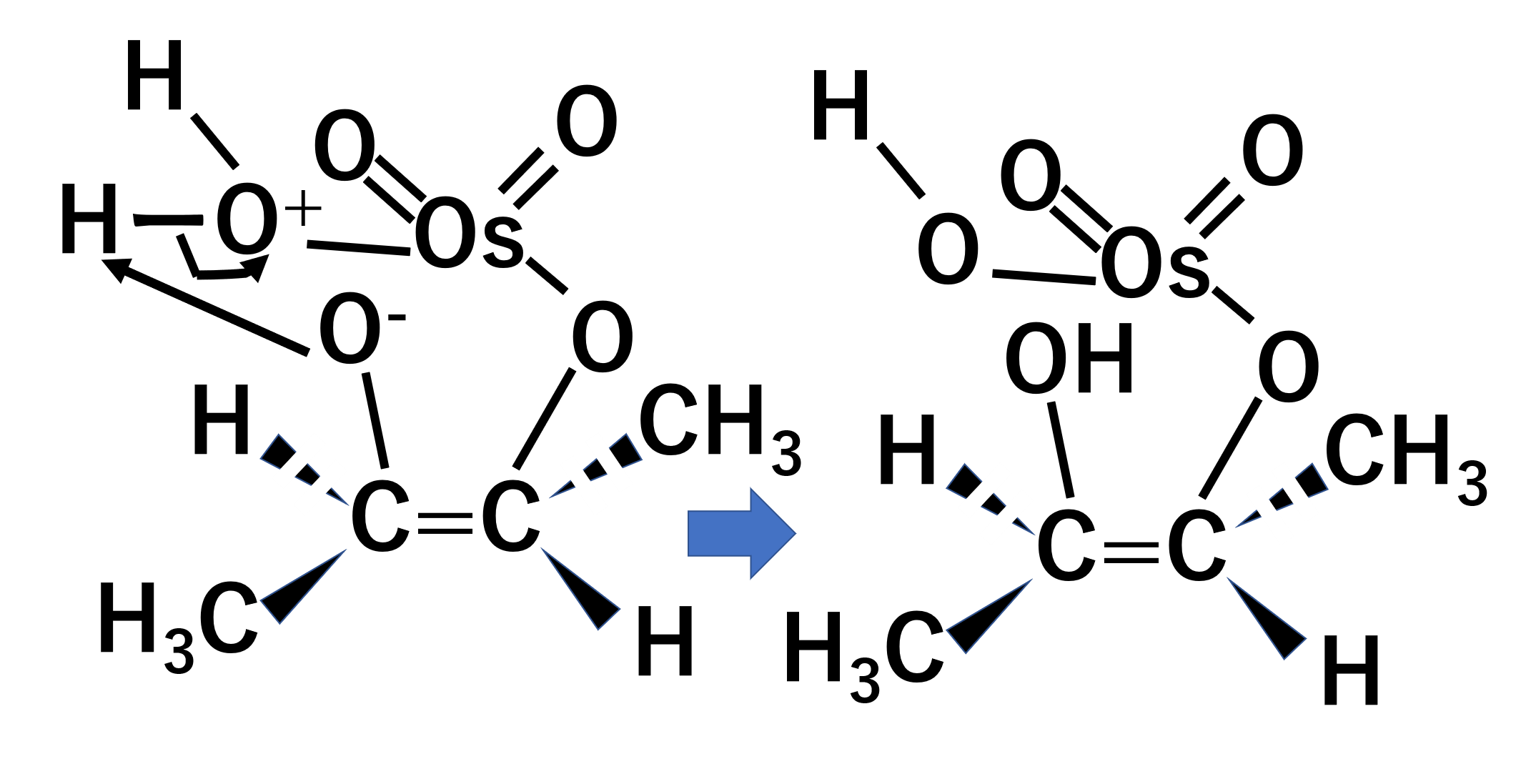
ここでは割愛しますが、これがもう片方も起こりOHがsyn付加します。
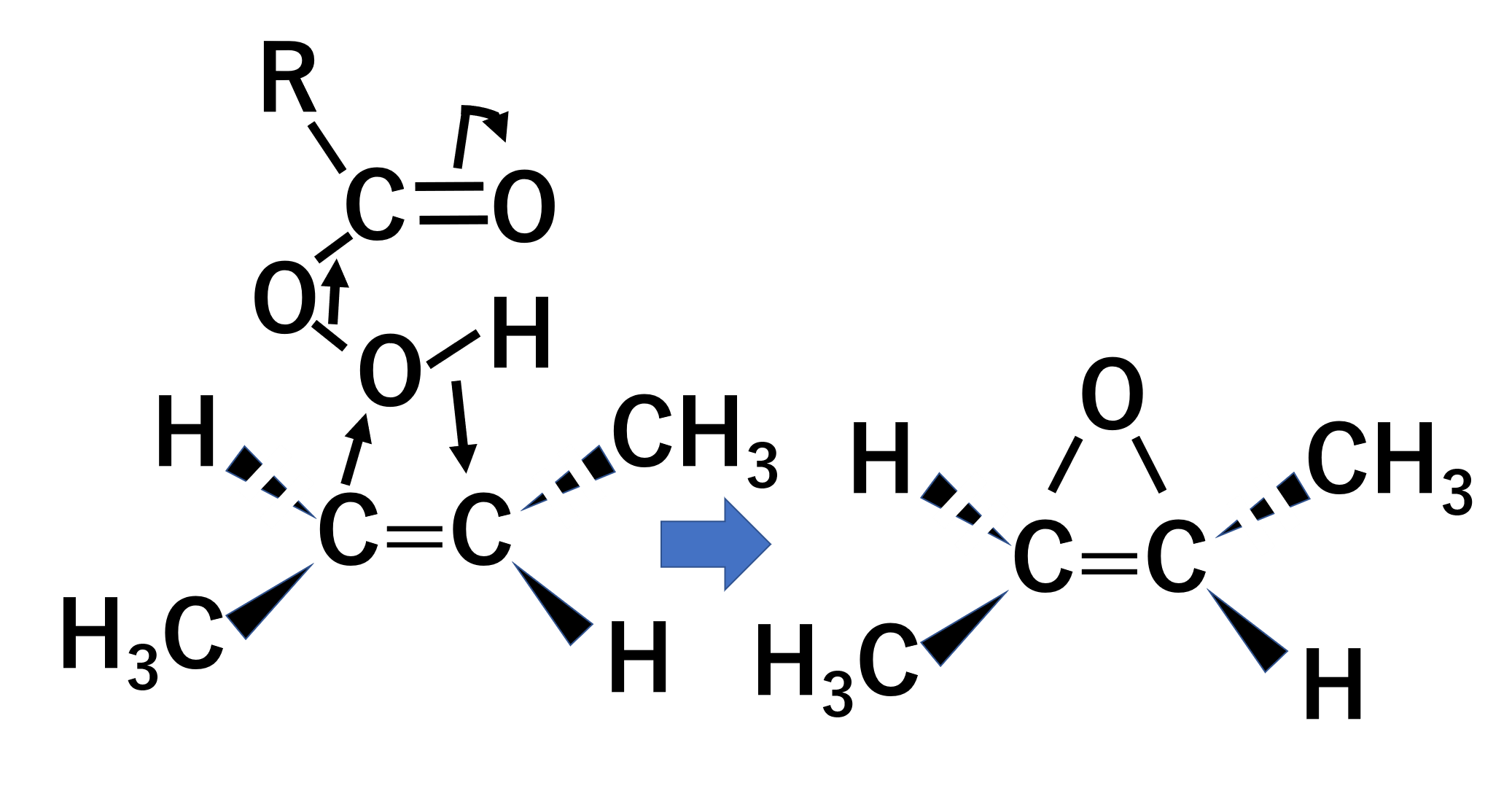
エポキシ化
酸素がsyn付加してエポキシドを作ります。trans-ブタ-2-エンのエポキシ化の例を見てみましょう。
アルケンのπ結合がm-クロロ過安息香酸などの過酸を攻撃してエポキシドを作ります。
まとめ
- アルケンの平面に対して両方とも同じ面に結合するのをsyn付加という
- アルケンの平面に対してそれぞれ別の麺から結合するのをanti付加という
- π結合の電子などを追うことが反応機構では大事。
