

Sponsored Link
製剤、pHと特殊酸塩基触媒作用
薬同士を混ぜると思わぬ化学反応が起こり、効果が落ちたり、副作用が起きたりします。有名なのが、注射薬の配合変化ですね。

これらの化学反応を起こす原因に、温度、酸化、光分解、加水分解などがありますが、今回は特にpHによる影響を見ていきたいと思います。
特殊酸塩基触媒作用
薬に酸(H+)や塩基(OH-)を加えると、触媒として働き反応速度が変わります。このH+やOH-によって、薬の分解を促進することを特殊酸塩基触媒作用と言います。なお、H+やOH-以外の酸塩基の場合は、一般酸塩基触媒作用と言います。
H+が触媒する場合とOH-が触媒する場合の、特殊酸塩基触媒作用をそれぞれ見てみます。
H+が触媒する場合
分解速度定数をk、酸触媒定数をkHとすると、H+で触媒される場合の速度定数の式はk=kH・[H+]で表されます。
これの対数をとると、logk=logkH+log[H+]と式変形できます。
ここで、log[H+]=-pHであるため、logk=-pH+logkHとなります。
縦軸をlogk、横軸をpHでグラフをかくとすると、y=-x+logkHと考えることができます。

このグラフからもわかるように傾きが-1であるため、グラフの左側の方が、logkが大きくなります。logkが大きいということは分解速度定数が大きいということになるため、酸性になるほど早く分解されることになります。
OH-が触媒する場合
先ほどと同様に、分解速度定数をk、塩基触媒定数をkOHとすると、OH-で触媒される場合の式はk=kOH・[OH-]で表されます。
これの対数をとると、logk=logkOH+log[OH-]と式変形できます。
ここで水のイオン積をKwとすると、log[OH-]=log(Kw/[H+])であるため、logk=logOH+log(Kw/[H+])となります。
さらに式変形をすすめ、logk=logOH+logKw-log[H+]となり、logk=pH-pKw+logOHとなります。
これも縦軸をlogk、横軸をpHでグラフを書くとすると、y=x-pKw+logOHとなります。

先ほどの酸のグラフと対照的に、傾きが+1であるため、グラフの右側の方が、logkが大きくなります。こちらも同様に考えると、塩基性になるほど早く分解されることになります。
ちなみに、酸と塩基両方の触媒を受ける場合は、k=kH・[H+]+koH・[OH-]となり、それぞれのグラフを合わせたようなグラフとなります。
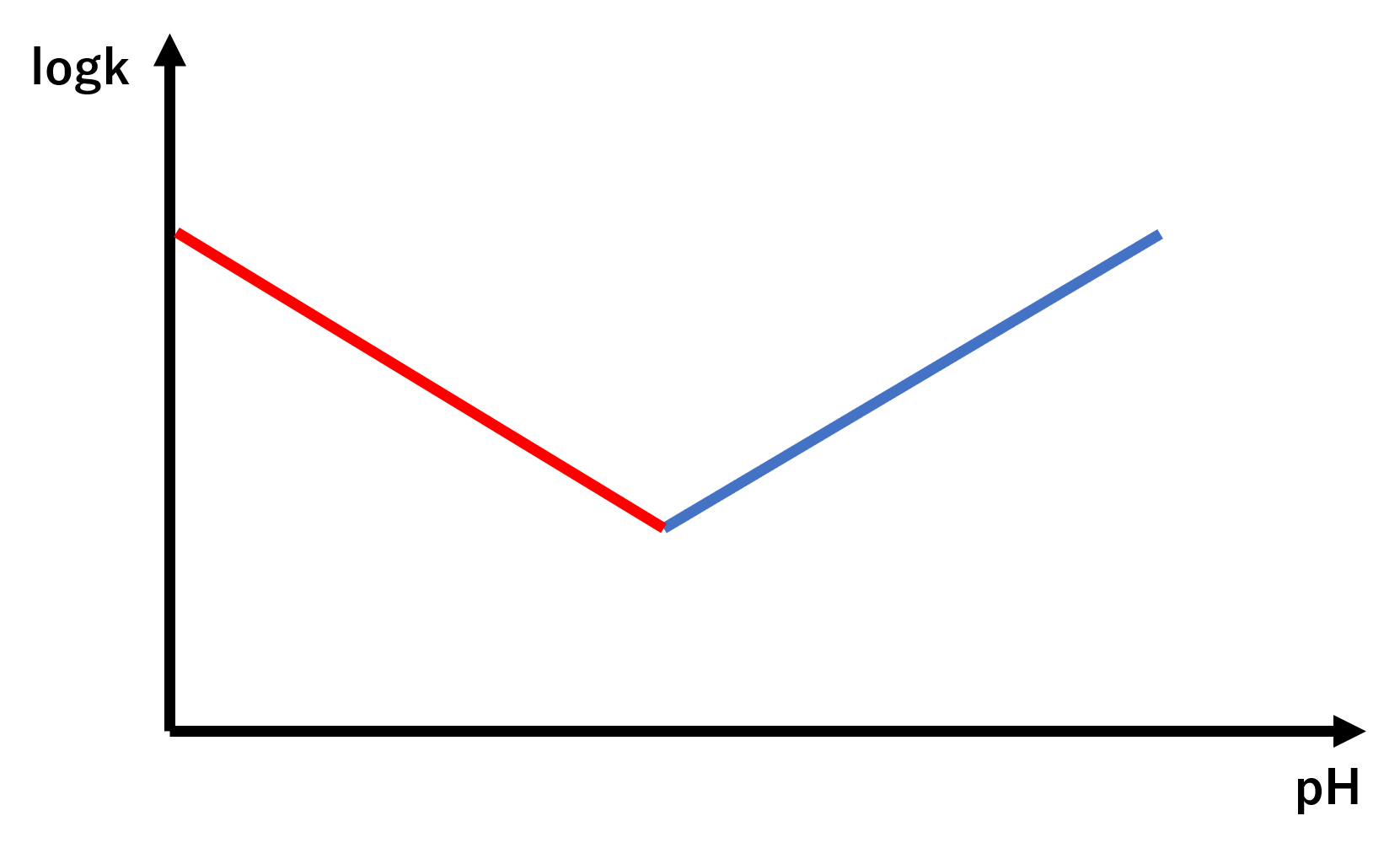
これらから、logkが一番小さくなるようにpHをコントロールすることで、薬の分解が最小限にすむということがわかります。
まとめ
- H+やOH-によって、薬の分解を促進することを特殊酸塩基触媒作用という。
- 分解速度定数を小さくするように、pHをコントロールすることで、薬の分解が最小限に抑えられる。
