Sponsored Link
薬機法、再審査と再評価の違い
前回の薬機法、製造販売の承認では医薬品や医療機器などの承認についてみました。今回は薬機法における再審査や再評価についてみていきたいと思います。
再審査とは
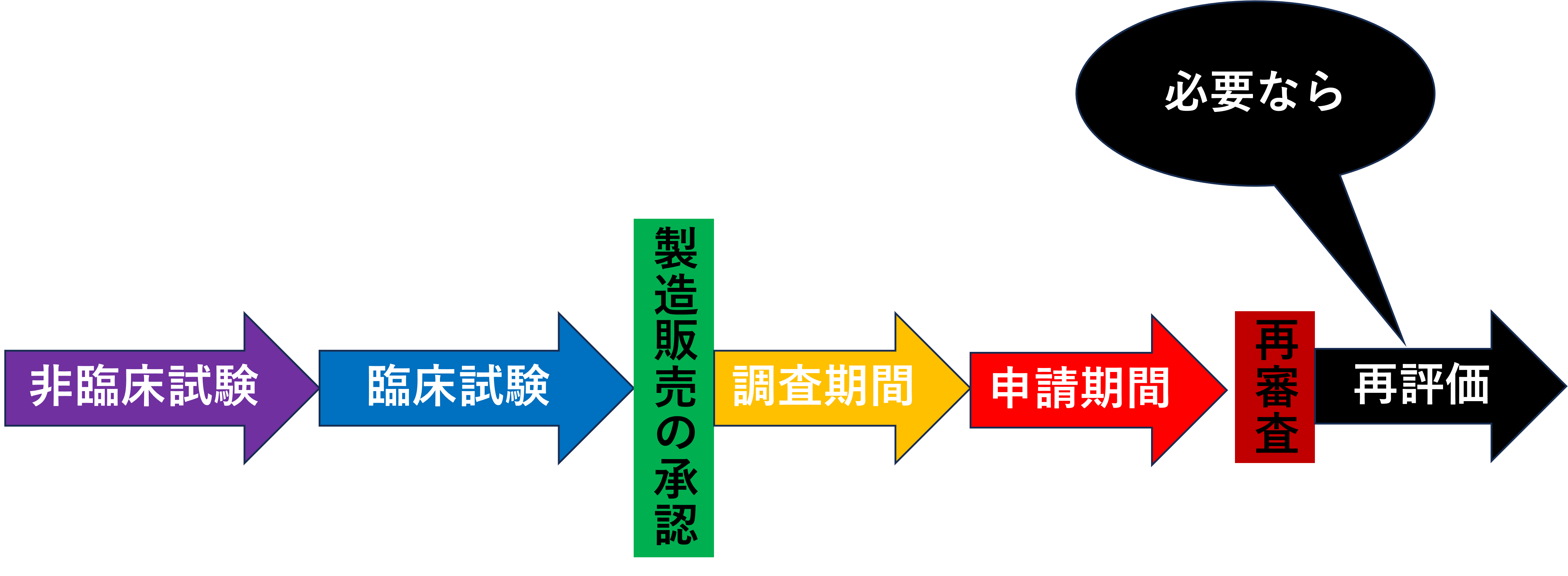
再審査の前に新医薬品を例に、市場に出回るまでの流れを見ましょう。
非臨床試験で動物などでデータを集めて問題なければ、臨床試験でヒトに対するデータを集めます。そしてヒトでも問題なければ、前回やった製造販売の承認を行い市場に出回ります。
新医薬品は承認を受けていると言えど、そのまま漠然と使い続ければよいというわけではありません。なぜならば臨床試験でデータを集めているといえど、そのデータ数は少なく、投与期間も短く、患者の年齢や併用薬などの観点などからも十分なデータ数がまだ集まっていないと言えるからです。
そのため製造販売後も新医薬品の安全性情報などを収集することは重要なことであり、製造販売後に定められた期間、品質、有効性、安全性などの情報を集めることには大きな意味があります。
Sponsored Link
Sponsored Link
よって厚生労働大臣が指定した新医薬品や新医療機器はその調査期間終了後に、その期間に集めた資料をもとに再び審査を受ける必要があります。これを再審査と呼び薬機法で定められています。
再審査は医薬品の製造販売後の調査及び試験の実施の基準に関わる省令(GPSP;Good Post-Marketing Study Practice)を順守して行われます。GPSPにおいて、製造販売業者は製造販売後調査等に関する業務を統括する者(製造販売後調査等管理責任者)を置き、管理責任者がつくった計画書に従って調査や試験を実施することが定められています。
再審査の申請期間は調査期間終了後に3か月以内に行わなくてはなりません。
再評価
再審査が終わり、市場に出回っている医薬品や医療機器に対して、厚生労働大臣が承認事項に適合しているかをGPSPに沿って集めた資料をもとに評価することを再評価と言います。
再審査は新医薬品や新医療機器が対象でしたが、再評価は全ての医薬品や医療機器が当てはまります。また、再審査は一度のみ行われますが、再評価は何度も行われます。
再審査と再評価と名前が似ていてややこしいですが違うものなので、しっかりとおさえましょう。
まとめ
- 新医薬品や新医療機器は調査期間終了後に、再審査を受ける必要がある。
- 再審査はGPSPを順守して行われ、調査期間終了後に3か月以内に行われなければならない。
- 再評価は全ての医薬品や医療機器が当てはまり、何度でも行われる。
薬機法、再審査と再評価の違い 関連ページ
- ヒポクラテスの誓い、ニュルンベルク綱領、ヘルシンキ宣言、リスボン宣言とは?
- 過去の歴史から、ヒポクラテスの誓い、ニュルンベルク綱領、ヘルシンキ宣言、リスボン宣言などの医療倫理に関わる規定が作られ、インフォームドコンセントのもととなりました。
- 薬剤師網領、薬剤師倫理規定、国際薬剤師・薬学連合薬剤師倫理規定、薬局業務運営ガイドラインとは?
- 薬剤師の倫理に関わるものには、薬剤師網領、薬剤師倫理規定、国際薬剤師・薬学連合薬剤師倫理規定、薬局業務運営ガイドラインなどがあります。
- 薬剤師が関わる法的責任のまとめ
- 薬剤師が関わる法的責任には、民事責任、刑事責任、行政法上の責任などがあります。民事責任では不法行為責任、債務不履行責任が、刑事責任では業務上過失致死傷罪、秘密漏示罪などがあります。
- 個人情報の保護に関する法律
- 個人情報の保護に関する法律では、個人情報は生存する個人に関する情報と定められています。また、個人情報を得る場合は事前に本人に知らせることが定められています。
- 薬剤師をとりまく法の構成
- 法の構成は憲法を頂点としたピラミッド型となっていて、上位のルールに反するものは無効です。法律は国会、政令は内閣、省令は各省大臣、条例は地方自治体で定められます。
- 薬機法総論
- 薬機法の目的とは医薬品、医薬部外品、化粧品、医療機器などの品質、有効性、安全性の確保などを通して、保健衛生の向上を図ることです。
- 薬機法、薬局の定義と開設許可
- 薬機法では薬局は医薬品の調剤と販売をするところと定義されています。薬局の開設には都道府県知事の許可が必要で有効期間は6年です。
- 薬機法、薬局の開設者と管理者
- 薬局の開設者は薬剤師でなくてもなることができるが、薬局の管理者は薬剤師でなければならないと薬機法で決められています。また薬局の管理者はその他の薬関係の仕事を兼業することが禁止されています。
- 薬機法、一般用医薬品の違い
- 第一類医薬品は薬剤師のみ販売でき、文書などでの情報提供が必要です。第三類医薬品は情報提供に関する規定はないのが違いです。第三類医薬品はネット販売もできますが都道府県知事の許可が必要です。
- 薬機法、製造販売業の許可
- 製造販売業の許可は厚生労働大臣に受け、5年ごとに更新が必要です。製造販売業の許可基準には、GQP、GVP、申請者の人的要件などがあります。
- 薬機法、製造業の許可
- 製造業の許可は厚生労働大臣が、厚生労働省令で定める区分に従い、厚生労働大臣が製造所ごとに与えます。更新は5年ごとです。製造業の許可基準に、構造設備や申請者の人的要件などがあります。
- 薬機法、製造販売の承認
- 製造販売の承認は品目ごとに厚生労働大臣が与えるが、薬事食品衛生審議会の意見を聞いて行います。製造販売の承認基準には製造販売業の許可、製造業の許可、品質有効性安全性、GMPへの適合などがあります。
- 薬機法、毒薬と劇薬の取り扱い
- 毒薬は黒地に白枠、白字をもつて、その品名及び「毒」の文字、劇薬は白地に赤枠、赤字をもつて、その品名及び「劇」の文字。毒薬は鍵もかけて他の薬と区別して陳列します。
- 薬機法、医薬品の表示や広告
- 原則として薬機法で医薬品の表示は、その直接の容器又は直接の被包に記載する項目が薬機法で決まっています。薬機法では、虚偽や誇大な広告を禁止しています。
